
【题目】当溶液中离子浓度小于1.0×10-5 molL-1 时,可视为该离子已完全除去,通过调节溶液pH的方法可以除去溶液中的某些杂质离子。常温下,某0.1 molL-1 的NiSO4溶液中含有杂质Al3+和 Fe3+,欲将这两种杂质完全除去, 需调节溶液pH 的范围可以是(不考虑溶液体积变化,已知:常温时,氢氧化镍Ksp = 1×10-16、 氢氧化铁Ksp =1×10-38、氢氧化铝Ksp = 1×10 -33)
A.2~3B.3~4
C.5 ~6D.6~8
【答案】C
【解析】
根据Ksp计算使得Al3+和Fe3+完全沉淀时溶液的pH值和Ni 2+开始沉淀时溶液的pH值,据此分析判断。
Ksp[Al(OH)3]=1×10-33=c(Al3+)×c3(OH-),c(Al3+)=1×10-5molL-1,解得:c(OH-)=![]() ×10-9molL-1,c(H+)=
×10-9molL-1,c(H+)=![]() ×10-5molL-1,pH略小于5时Al3+完全变成沉淀;同理,Ksp[Fe(OH)3]=1×10-38=c(Fe3+)×c3(OH-),c(Fe3+)=1×10-5molL-1,解得:c(OH-)=1 ×10-11molL-1,c(H+)=1×10-3molL-1,pH=3时Fe3+完全变成沉淀;Ksp[Ni(OH)2]=1×10-16=c(Ni 2+)×c2(OH-),c(Ni 2+)=0.1molL-1,解得:c(OH-)=
×10-5molL-1,pH略小于5时Al3+完全变成沉淀;同理,Ksp[Fe(OH)3]=1×10-38=c(Fe3+)×c3(OH-),c(Fe3+)=1×10-5molL-1,解得:c(OH-)=1 ×10-11molL-1,c(H+)=1×10-3molL-1,pH=3时Fe3+完全变成沉淀;Ksp[Ni(OH)2]=1×10-16=c(Ni 2+)×c2(OH-),c(Ni 2+)=0.1molL-1,解得:c(OH-)=![]() ×10-7molL-1,c(H+)=
×10-7molL-1,c(H+)=![]() ×10-7molL-1,pH略小于7时Ni 2+开始变成沉淀;因此需调节溶液pH 的范围为5 ~6。
×10-7molL-1,pH略小于7时Ni 2+开始变成沉淀;因此需调节溶液pH 的范围为5 ~6。
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】2019年8月13日中国科学家合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2 [Sn(OH)6][B(OH)4] 2并获得了该化合物的LED器件,该研究结果有望为白光发射的设计和应用提供一个新的有效策略。
(1)基态Sn原子价层电子的空间运动状态有___种,基态氧原子的价层电子排布式不能表示为![]() ,因为这违背了____原理(规则)。
,因为这违背了____原理(规则)。
(2)[B(OH)4] -中氧原子的杂化轨道类型为____,[B(OH)4] -的空间构型为______。 [Sn(OH)6] 2-中,Sn与O之间的化学键不可能是___。
a ![]() 键 b σ键 c 配位键 d 极性键
键 b σ键 c 配位键 d 极性键
(3)碳酸钡、碳酸镁分解得到的金属氧化物中,熔点较低的是_____(填化学式),其原因是___________。
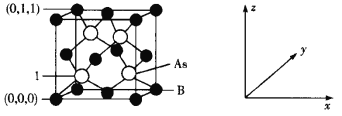
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如下图所示,则1号砷原子的坐标为____。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为__g·cm-3(列出含a、NA的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是( )
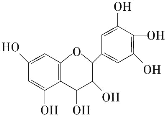
A.该物质可以看作醇类,也可看做酚类
B.1mol该物质可与7molNa2CO3反应
C.该物质遇FeCl3会发生显色反应
D.1mol该物质可与4molBr2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T°C时,在某恒容的密闭容器中,发生如下反应:SO2(g) +2CO(g) ![]() 2CO2 (g)+ S(l)△H < 0;下列情况不能说明该反应达到平衡状态的是
2CO2 (g)+ S(l)△H < 0;下列情况不能说明该反应达到平衡状态的是
A.容器内混合气体的密度不变
B.容器内压强不变
C.v(CO)生成= v(CO2)消耗
D.S的质量不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,溶液的导电能力如图1所示,溶液的pH 变化如图2所示(已知:常温时,NH3H2O和CH3COOH的电离常数均为1.8×10-5), 下列说法正确的是
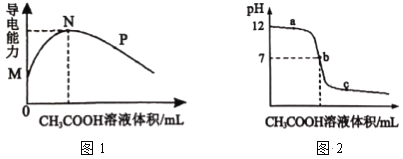
A.图l中N点时,加入CH3COOH溶液的体积为l 0 mL
B.MOH是一种弱碱,相同条件下其碱性弱于 NH3H2O 的碱性
C.图2中b点时,加入CH3COOH溶液的体积为l 0 mL
D.若c点对应醋酸的体积是15 mL,则此时溶液中:c(CH3COOH) + c(CH3COO-) < 0.1 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )
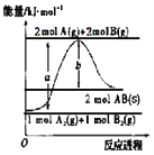
A.该反应热△H=+(a﹣b)kJmol﹣1
B.AB(g)═A2(g)+B2(g)△H=+b/2kJmol﹣1
C.断裂1 mol A﹣A键和1 mol B﹣B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.46g乙醇中存在的共价键总数为7NA
B.HNO3作为氧化剂得到的电子数一定为3NA
C.1mol甲醇完全燃烧时,转移的电子数为6NA
D.将3.4g H2S全部溶于水,所得溶液中HS-和S2-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的( )
A.质量B.密度C.碳原子数D.原子总数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com