
【题目】同温同压下两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的( )
A.质量B.密度C.碳原子数D.原子总数
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】当溶液中离子浓度小于1.0×10-5 molL-1 时,可视为该离子已完全除去,通过调节溶液pH的方法可以除去溶液中的某些杂质离子。常温下,某0.1 molL-1 的NiSO4溶液中含有杂质Al3+和 Fe3+,欲将这两种杂质完全除去, 需调节溶液pH 的范围可以是(不考虑溶液体积变化,已知:常温时,氢氧化镍Ksp = 1×10-16、 氢氧化铁Ksp =1×10-38、氢氧化铝Ksp = 1×10 -33)
A.2~3B.3~4
C.5 ~6D.6~8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示反应 NaHSO4+NaHCO3=Na2SO4 + H2O十CO2↑中相关微粒的化学用语不正确的是
A.CO2的结构式: O=C= O
B.H2O的电子式:![]()
C.Na+的结构示意图:![]()
D.水溶液中,NaHCO3的电离方程式: NaHCO3=Na+ + H+ + CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
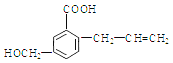
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用醇的消去反应是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示,可能用到的有关数据如下:
相对分子质量 | 密度(g·cm-3) | 沸点/℃ | 溶解性 | |
环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
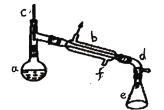
a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。反应粗产物倒入f中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过蒸馏得到纯净环已烯。回答下列问题:
(1)由环己醇制取环己烯的方程式___________________________________________;
(2)装置b的冷凝水方向是______(填下进上出或上进下出);
(3)加入碎瓷片的作用是______;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是______(填正确答案标号)。
A.立即补加B.冷却后补加C.不需补加D.重新配料
(4)本实验中最容易产生的副产物所含的官能团名称为___________。
(5)在分离提纯中,使用到的仪器f名称是______,分离氯化钙的操作是_______。
(6)合成过程中加入浓硫酸的作用是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制100mL0.20mol·L-1的KCl溶液,实验操作如下:
A. 用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
B. 加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
C .将KCl溶液由烧杯小心倒入100mL容量瓶中;
D .然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
E.使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____________(填写字母序号)。
(2)下面哪些操作会导致所配的100mL0.20mol/L的KCl溶液浓度降低___________。
A 容量瓶用蒸馏水洗涤三次直到洗净 B 称量KCl固体时将砝码放在左盘
C 未洗涤转移KCl溶液的烧杯 D 转移KCl溶液时有KCl溶液溅出
E 定容时仰视刻度线
(3)若用0.2mol·L-1的KCl溶液配制0.05mol·L-1的KCl溶液200.0mL,需要0.20mol·L-1的KCl溶液____________mL。
(4)若在标准状况下,将V LHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填字母)
A ![]() B
B ![]() C
C ![]()
![]() D
D ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于燃烧热的描述中正确的是( )
A. 已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1
B. 将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. 葡萄糖的燃烧热是2800kJ·mol-1,则![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将氨水与氯化铵溶液混合得到c(NH3·H2O)+c(NH4+)=0.l mol·L-1的溶液。溶液中c(NH3·H2O)、c(NH4+)与pH的关系如下图所示。下列有关离子浓度关系叙述一定正确的是( )
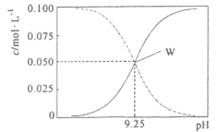
A.W点表示溶液中:c(NH3·H2O)+c(H+)=c(Cl-)+c(OH-)
B.pH=7.0溶液中: c(NH3·H2O)>c(NH4+)>c(OH-)=c(H+)
C.pH=10.5的溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1
D.向W点所表示的1 L溶液中加入0.05 mol NaOH固体(忽略溶液体积变化):c(Na+)>c(Cl-)>c(OH-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子的性质的解释中,不正确的是:
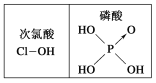
A.碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B.乳酸![]() 有一对对映异构体,因为其分子中含有一个手性碳原子
有一对对映异构体,因为其分子中含有一个手性碳原子
C.水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键
D.由图知酸性:H3PO4>HClO,因为H3PO4的非羟基氧原子数大于次氯酸的非羟基氧原子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com