
【题目】某同学欲配制100mL0.20mol·L-1的KCl溶液,实验操作如下:
A. 用托盘天平准确称取1.49gKCl固体,并放入烧杯中;
B. 加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,并恢复至室温;
C .将KCl溶液由烧杯小心倒入100mL容量瓶中;
D .然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水;
E.使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶。
(1)该学生操作中错误的是____________(填写字母序号)。
(2)下面哪些操作会导致所配的100mL0.20mol/L的KCl溶液浓度降低___________。
A 容量瓶用蒸馏水洗涤三次直到洗净 B 称量KCl固体时将砝码放在左盘
C 未洗涤转移KCl溶液的烧杯 D 转移KCl溶液时有KCl溶液溅出
E 定容时仰视刻度线
(3)若用0.2mol·L-1的KCl溶液配制0.05mol·L-1的KCl溶液200.0mL,需要0.20mol·L-1的KCl溶液____________mL。
(4)若在标准状况下,将V LHCl气体溶于1L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为________mol/L。(填字母)
A ![]() B
B ![]() C
C ![]()
![]() D
D ![]()
【答案】ACD BCDE 50.0 A
【解析】
用固体溶质配制一定物质的量浓度的溶液需要经过计算、称量、溶解、转移、洗涤、定容、摇匀、转移等步骤。
(1)A.托盘天平称量物体时只能准确到0.1g,所以无法用托盘天平准确称取1.49gKCl故体,故A错误;
B.加入约30mL蒸馏水,用玻璃棒搅拌使其溶解,由于容量瓶不能受热,故要将溶液恢复至室温,故B正确;
C.将KCl溶液转移到容量瓶中时,需要用玻璃棒引流,不能直接倒入,故C错误;
D.将KCl溶液转移到容量瓶中后要用蒸馏水洗涤所用的烧杯和玻璃棒2~3次,把洗涤液也转移到容量瓶中,然后再加蒸馏水定容,故D错误;
E.定容时,开始时直接往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,轻轻摇动容量瓶并静置片刻后,改用胶头滴管滴加蒸馏水使溶液凹面最低点恰好与刻度相切,把容量瓶盖好,上下翻转摇匀后装瓶,故E正确;
综上所述选ACD。
(2)A.配制溶液前,容量瓶需要洗涤干净,即使里面有一些残留的蒸馏水,对溶质和最终得到的溶液体积也没有影响,故A不选;
B.称量KCl固体时将砝码放在左盘,称量过程中需要使用游码,则会使溶质的物质的量变少,导致所配溶液浓度降低,故B选;
C.未洗涤转移KCl的烧杯,会使溶质没有全部转移到容量瓶中,导致所配溶液浓度降低,故C选;
D.转移KCl溶液时有KCl溶液溅出,溶质有损失,会导致所配溶液浓度降低,故D选;
E.定容时仰视刻度线,会导致加入的蒸馏水超过刻度线,溶液体积变大,溶液浓度降低,故E选;
综上所述选BCDE;
(3)用比较浓的溶液配制稀溶液,需要向浓溶液里加水稀释,根据稀释前后溶质的物质的量不变可得0.2mol·L-1V=0.05mol·L-1×0.2L,可求得V=0.05L,即50.0mL;
(4)标准状况下,VLHCl的物质的量为![]() ,质量为
,质量为![]() ,1L水为1000g,所以盐酸的质量为
,1L水为1000g,所以盐酸的质量为![]() ,根据盐酸的密度可求出盐酸的体积:
,根据盐酸的密度可求出盐酸的体积: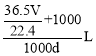 ,所以盐酸中HCl的物质的量浓度为
,所以盐酸中HCl的物质的量浓度为![]() ,故答案为A。
,故答案为A。


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,溶液的导电能力如图1所示,溶液的pH 变化如图2所示(已知:常温时,NH3H2O和CH3COOH的电离常数均为1.8×10-5), 下列说法正确的是
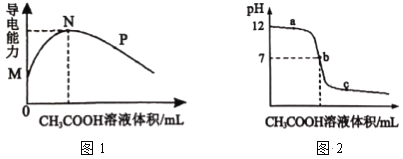
A.图l中N点时,加入CH3COOH溶液的体积为l 0 mL
B.MOH是一种弱碱,相同条件下其碱性弱于 NH3H2O 的碱性
C.图2中b点时,加入CH3COOH溶液的体积为l 0 mL
D.若c点对应醋酸的体积是15 mL,则此时溶液中:c(CH3COOH) + c(CH3COO-) < 0.1 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知工业上常用“有效氢含量”衡量含氢还原剂的还原能力,其定义为 :每克含氢还原剂的还原能力相当于多少克H2的还原能力。硼氢化钠(NaBH4)是一种极强的含氢还原剂,下列有关说法正确的是
A.NaBH4作还原剂时 ,其中的硼元素被氧化
B.NaBH4 的“有效氢含量”约为0.21
C.反应8Au3+ +BH![]() +OH-→ 8Au+BO
+OH-→ 8Au+BO![]() +H2O中水的化学计量数为16
+H2O中水的化学计量数为16
D.NaBH4遇水产生大量的氧气可作供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酯A,其分子式C6H12O2,已知有机物A、B、C、D、E有如图的转化关系,又知C不能发生银镜反应,E能发生银镜反应,则A结构可能有
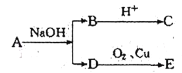
A.5种B.6种C.8种D.9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶气体一定具有相同的( )
A.质量B.密度C.碳原子数D.原子总数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2 min B的浓度减少0.6 molL-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 molL-1min-1
B.2min末的反应速率v(C)=0.2 molL-1min-1
C.2min内D的物质的量增加0.2mol
D.若起始时A、B的物质的量之比为4∶3,则2 min末A、B的转化率之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如图所示,下列说法不正确的是( )
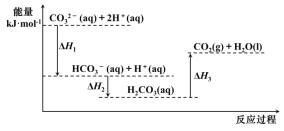
A.反应![]() (aq)+H+(aq)═CO2(g)+H2O(l) △H>0
(aq)+H+(aq)═CO2(g)+H2O(l) △H>0
B.![]() (aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3
(aq)+2H+(aq)═CO2(g)+H2O(l) △H=△H1+△H2+△H3
C.△H1>△H2,△H2<△H3
D.H2CO3(aq)═CO2(g)+H2O(l),若使用催化剂,则△H3不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2CO3和NaHCO3在生活和生产中应用广泛。
(1)室温时下列指定溶液中微粒物质的量浓度关系正确的是_____ (填字母) .
A.0.1mol·L-1的Na2CO3溶液: c(Na+)+c(H+) =c(OH-)+c(![]() )+c(
)+c(![]() )
)
B.0.1mol·L-1的NaHCO3溶液: c(Na+) =c(![]() ) + c(
) + c(![]() )+ c(H2CO3)
)+ c(H2CO3)
C.0.1mol·L-1的NaHCO3溶液: c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(![]() )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(![]() )
)
(2)水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,  =________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
=________;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
(3) 25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。
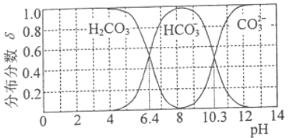
①纯碱溶液去油污的原理是_________(用离子方程式表示) 。25℃时,该反应的平衡常数表示为Kh,则pKh=_________(pKh=-lgKh)。
②25C时,下列三种溶液
A.0.1mol·L-1的NaHCO3溶液:
B.0.1mol·L-1的Na2CO3溶液:
C.0.1mol·L-1的NaCN溶液。
pH由大到小的顺序为________________(填字母)。[25℃时,K(HCN)= 10-9.3]
(4)NaHCO3可用于铝土矿(主要成分为Al2O3,含SiO2和Fe2O3)制铝。流程如下:
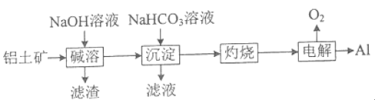
①滤渣中除含SiO2转化得到的铝硅酸钠外,还含_____(填化学式) 。
②写出“沉淀"步骤发生反应的离子方程式________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中由于哑铃形的C![]() 存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是:
存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是:
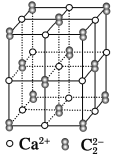
A.1个Ca2+周围距离最近且等距离的C![]() 数目为6
数目为6
B.该晶体中的阴离子与F2是等电子体
C.6.4 g CaC2晶体中含阴离子0.1 mol
D.与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com