
| c2(SO3) |
| c2(SO2)c(O2) |
| c2(SO3) |
| c2(SO2)c(O2) |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、某自发的化学反应,若△S<0,则该自发反应一定为放热反应 |
| B、利用电化学原理保护金属的一种方法是把被保护金属作为阳极,而另一比其更活泼的金属作为阴极 |
| C、对于反应2NH3(g)?N2(g)+3H2(g),减小体积增大压强,反应物活化分子数及活化分子百分数均不发生改变 |
| D、改变条件,使化学平衡往正向移动,反应物的转化率不一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
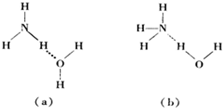 按要求填空
按要求填空查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
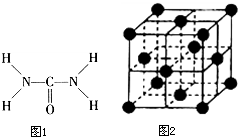 如图1,已知尿素的结构式为:尿素可用于制有机铁肥,主要代表物有三硝酸,六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6]
如图1,已知尿素的结构式为:尿素可用于制有机铁肥,主要代表物有三硝酸,六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6]查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.03mol?L-1 |
| B、0.05mol?L-1 |
| C、0.5mol?L-1 |
| D、0.04mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com