
【题目】砷(![]() )元素广泛的存在于自然界,在周期表中的位置如表。
)元素广泛的存在于自然界,在周期表中的位置如表。
|
| |
|
| |
|
|
完成下列填空:
(1)砷元素最外层电子的排布式为______________。
(2)砷化镓(![]() )和氮化硼(
)和氮化硼(![]() )晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,
)晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,![]() 的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
(3)亚砷酸盐(![]() )在碱性条件下与碘单质反应生成砷酸盐(
)在碱性条件下与碘单质反应生成砷酸盐(![]() ),完成反应的离子方程式: ____
),完成反应的离子方程式: ____![]() +I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
+I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
(4)工业上将含有砷酸盐(![]() )的废水转化为粗
)的废水转化为粗![]() 的工业流程如下:
的工业流程如下:
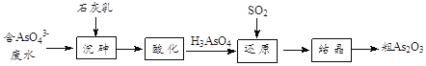
①写出还原过程中砷酸![]() 转化为亚砷酸
转化为亚砷酸![]() 的化学方程式: ___________
的化学方程式: ___________
②“沉砷”是将![]() 转化为
转化为![]() 沉淀,主要反应有:
沉淀,主要反应有:
i.Ca(OH)2(s)Ca2+(aq)+2OH—(aq)+Q
ii.5Ca2++OH—+3![]() Ca5(AsO4)3OH-Q
Ca5(AsO4)3OH-Q
沉砷最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因___。
【答案】![]()
![]() 和
和![]() 都是原子晶体,原子半径:
都是原子晶体,原子半径:![]() ,
,![]() ,则共价键键长:
,则共价键键长:![]() 键
键![]() 键,键能:
键,键能:![]() 键
键![]() 键,所以熔点
键,所以熔点![]() 低于BN 1 2OH—
低于BN 1 2OH— ![]() +2I—+H2O 溶液酸碱性
+2I—+H2O 溶液酸碱性 ![]() 反应i为放热反应,高于85℃时,平衡向逆反应方向移动,
反应i为放热反应,高于85℃时,平衡向逆反应方向移动,![]() 减小;反应ii中
减小;反应ii中![]() 减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降
减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降
【解析】
(1)As与N同主族,据此判断As在周期表中的位置;
(2) 砷化镓(![]() )和氮化硼(
)和氮化硼(![]() )晶体都具有空间网状结构,硬度大,两者都是原子晶体,原子半径越小,形成的共价键键长越短,共价键键能越大,共价键越稳定,晶体的熔点越高;
)晶体都具有空间网状结构,硬度大,两者都是原子晶体,原子半径越小,形成的共价键键长越短,共价键键能越大,共价键越稳定,晶体的熔点越高;
(3)碘单质将![]() 氧化成
氧化成![]() ,自身被还原为碘离子,根据化合价升降守恒配平书写方程式;
,自身被还原为碘离子,根据化合价升降守恒配平书写方程式;
(4)向工业废水(含![]() )加入石灰乳沉砷得到Ca5(AsO4)3OH沉淀,用稀硫酸溶解沉淀,生成H3AsO4和硫酸钙,通入二氧化硫将H3AsO4还原为H3AsO3,“还原”后加热溶液,H3AsO3分解为As2O3,冷却结晶,过滤,得粗As2O3,据此分析解答。
)加入石灰乳沉砷得到Ca5(AsO4)3OH沉淀,用稀硫酸溶解沉淀,生成H3AsO4和硫酸钙,通入二氧化硫将H3AsO4还原为H3AsO3,“还原”后加热溶液,H3AsO3分解为As2O3,冷却结晶,过滤,得粗As2O3,据此分析解答。
(1)As在周期表的第4周期第ⅤA族,最外层电子的排布式是4s24p3,故答案为:4s24p3;
(2)砷化镓(![]() )和氮化硼(
)和氮化硼(![]() )晶体都具有空间网状结构,硬度大,砷化与氮化硼属于同种晶体类型,均属于原子晶体,原子半径N<As,B<Ga,故N-B键的键长比As-Ga键的键长短,N-B键的键能更大,更稳定,所以氮化硼的熔点较高,故答案为:GaAs和BN都是原子晶体,原子半径:Ga>B,As>N,则共价键键长:Ga-As键>B-N键,键能:Ga-As键<B-N键,所以熔点GaAs低于BN;
)晶体都具有空间网状结构,硬度大,砷化与氮化硼属于同种晶体类型,均属于原子晶体,原子半径N<As,B<Ga,故N-B键的键长比As-Ga键的键长短,N-B键的键能更大,更稳定,所以氮化硼的熔点较高,故答案为:GaAs和BN都是原子晶体,原子半径:Ga>B,As>N,则共价键键长:Ga-As键>B-N键,键能:Ga-As键<B-N键,所以熔点GaAs低于BN;
(3)碘单质将![]() 氧化成
氧化成![]() ,As的化合价从+3升到+5,自身被还原为碘离子,碘的化合价从0降到-1,根据化合价升降守恒及溶液的碱性环境,离子方程式为
,As的化合价从+3升到+5,自身被还原为碘离子,碘的化合价从0降到-1,根据化合价升降守恒及溶液的碱性环境,离子方程式为![]() +I2+2OH—
+I2+2OH—![]() +2I—+H2O,该反应为可逆反应,说明氧化还原反应的方向和溶液酸碱性有关,故答案为:1;2OH—;
+2I—+H2O,该反应为可逆反应,说明氧化还原反应的方向和溶液酸碱性有关,故答案为:1;2OH—;![]() +2I—+H2O;溶液酸碱性;
+2I—+H2O;溶液酸碱性;
(4)①“还原”过程中二氧化硫将H3AsO4转化为H3AsO3,反应的化学方程式为:H3AsO4+H2O+SO2=H3AsO3+H2SO4,故答案为:H3AsO4+H2O+SO2=H3AsO3+H2SO4;
②“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反反应:i.Ca(OH)2(s)Ca2+(aq)+2OH—(aq)+Q,ii.5Ca2++OH—+3![]() Ca5(AsO4)3OH-Q,高于85℃后,温度升高,反应i平衡逆向移动,c(Ca2+)下降,反应ii平衡逆向移动,Ca5(AsO4)3OH沉淀率下降,故答案为:反应i为放热反应,高于85℃时,平衡向逆反应方向移动,c(Ca2+)减小;反应ii中c(Ca2+)减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降。
Ca5(AsO4)3OH-Q,高于85℃后,温度升高,反应i平衡逆向移动,c(Ca2+)下降,反应ii平衡逆向移动,Ca5(AsO4)3OH沉淀率下降,故答案为:反应i为放热反应,高于85℃时,平衡向逆反应方向移动,c(Ca2+)减小;反应ii中c(Ca2+)减小是影响平衡移动的主要因素,所以反应ii平衡也向逆反应方向移动,沉淀率下降。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。

(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.0.5 mol雄黄(As4S4)(结构如图:![]() )含有NA个S—S键
)含有NA个S—S键
B.1 mol CO和N2混合气体中含有的质子数为14NA
C.标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA
D.高温下,16.8 g Fe与足量水蒸气完全反应,转移的电子数为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜制碱法可以做到连续循环生产,其工艺流程如下图所示。完成下列填空:

(1)写出流程中主反应的化学方程式:_________。
(2)流程通过同时利用合成氨厂产生的_______来降低原料成本。副产物b的化学式为______,简述降温条件下加入原料A的作用__________。侯氏制碱法的创新之处就是对母液的循环利用,这是由于母液中含有大量的![]() 、
、![]() 、_______离子。
、_______离子。
某兴趣小组同学制定如下两个方案对含有![]() 杂质的纯碱的含量进行测定:
杂质的纯碱的含量进行测定:
方案一:用如图装置测定样品与足量稀硫酸反应生成![]() 的体积。
的体积。
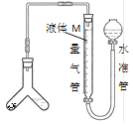
(3)为了减小实验误差,量气管中液体M的选择原则是______。若实验测得样品纯碱含量低于样品实际含量,可能的原因是_________
a ![]() 气体中含有水蒸气 b 测定气体体积时未冷却至室温
气体中含有水蒸气 b 测定气体体积时未冷却至室温
c Y型管中留有反应生成的气体 d 测定气体体积时水准管的液面高于量气管的液面
方案二:通过以下流程测定样品的含量。

(4)操作Ⅰ的名称为________,实验中,恒重的标准为________。根据以上实验过程,含有氯化钠的纯碱样品中碳酸钠的质量分数可表示为:_______。(注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以多孔铂为电极,在如图装置中分别在两极区通入CH3OH和O2,发生反应产生电流,经测定,电流方向由b到a,下列叙述中正确的是( )

A.负极的电极反应为:2CH3OH+16OH-12e-=2CO32-+12H2O
B.溶液中的阳离子向a极运动
C.A处通入O2
D.b极是该燃料电池的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气,其反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)求生成氯气的体积(标准状况)______________
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题
(1)利用某分子筛作催化剂,NH3可脱除工厂废气中的NO、NO2,反应机理如下图所示。A包含物质为H2O和___________(填化学式)

(2)已知:4NH3(g)+6NO(g) =5N2(g)+6H2O(g) △H1=-a kJ/mol
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H2=-b kJ/mol
H2O(l)=H2O(g) △H3=+c kJ/mol
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)的△H=___________ kJ/mol
(3)工业上利用氨气生产氢氰酸(HCN的反应为:CH4(g)+NH3(g)![]() HCN(g)+3H2(g ) △H>0
HCN(g)+3H2(g ) △H>0
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图甲所示。则X可以是___________(填字母序号)

a.温度 b.压强 c.催化剂 d.![]()
②在一定温度下,向2L密闭容器中加入 n mol CH4和2 moI NH3,平衡时NH3体积分数随n变化的关系如图乙所示。

a点时,CH4的转化率为___________%;平衡常数:K(a)_____K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与O2结合生成MbO2,其反应原理可表示为: Mb(ag)+O2(g)![]() MbO2(aq),该反应的平衡常数可表示为:
MbO2(aq),该反应的平衡常数可表示为:![]() 。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[
。在37℃条件下达到平衡时,测得肌红蛋白的结合度(a)与P(O2)的关系如图丙所示[![]() ]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。
]。研究表明正反应速率ν正=k正·c(Mb) · P(O2),逆反应速率ν逆=k逆·c(MbO2)(其中k正和k逆分别表示正反应和逆反应的速率常数)。

①试写出平衡常数K与速率常数k正、k逆之间的关系式为K=___________(用含有k正、k逆的式子表示)。
②试求出图丙中c点时,上述反应的平衡常数K=___________kPa-1。已知k逆=60s-1,则速率常数k正=___________s-1·kPa-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:
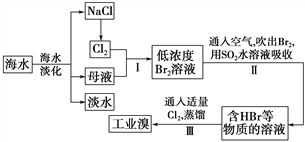
(1)请列举海水淡化的两种方法:________、________。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是_________。
(3)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_______,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______。
(4)某化学研究性学习小组为了了解从工业溴中提纯溴的方法,查阅了有关资料知:Br2的沸点为59 ℃,微溶于水,有毒并有强腐蚀性。他们参观生产过程后,画了如下装置简图:
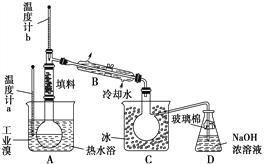
请你参与分析讨论:
①图中仪器B的名称是____________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因是__________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件?___________。
④C中液体颜色为________________。为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。
(1)工业上用克劳斯工艺处理含H2S的尾气获得硫黄,流程如下:
![]()
①反应炉中的反应:2H2S(g)+3O2(g) =2SO2(g)+2H2O(g) H=-1035.6 kJ·mol1
催化转化器中的反应:2H2S(g)+SO2(g) = 3S(g)+2H2O(g) H=-92.8 kJ·mol1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______。
②为了提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率为______。
(2)科研工作者利用微波法处理尾气中的H2S并回收H2和S,反应为:H2S![]() H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
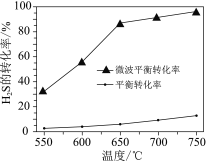
①H2S分解生成H2和S的反应为______反应(填“吸热”或“放热”)。
②微波的作用是______。
(3)某科研小组将微电池技术用于去除天然气中的H2S,装置示意图如下,主要反应:2Fe+2H2S+O2= 2FeS+2H2O(FeS难溶于水),室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。

①装置中微电池负极的电极反应式:______。
②一段时间后,单位时间内H2S的去除率降低,可能的原因是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com