
【题目】石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。
(1)工业上用克劳斯工艺处理含H2S的尾气获得硫黄,流程如下:
![]()
①反应炉中的反应:2H2S(g)+3O2(g) =2SO2(g)+2H2O(g) H=-1035.6 kJ·mol1
催化转化器中的反应:2H2S(g)+SO2(g) = 3S(g)+2H2O(g) H=-92.8 kJ·mol1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______。
②为了提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率为______。
(2)科研工作者利用微波法处理尾气中的H2S并回收H2和S,反应为:H2S![]() H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
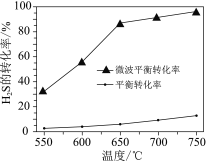
①H2S分解生成H2和S的反应为______反应(填“吸热”或“放热”)。
②微波的作用是______。
(3)某科研小组将微电池技术用于去除天然气中的H2S,装置示意图如下,主要反应:2Fe+2H2S+O2= 2FeS+2H2O(FeS难溶于水),室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。

①装置中微电池负极的电极反应式:______。
②一段时间后,单位时间内H2S的去除率降低,可能的原因是______。
【答案】2H2S(g)+O2(g) = 2S(g)+2H2O(g) H=-407.1 kJ·mol1 ![]() 或33.3% 吸热 微波使H2SH2+S的化学平衡向正反应方向移动,提高平衡转化率 Fe-2e-+H2S= FeS+2H+ 生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢
或33.3% 吸热 微波使H2SH2+S的化学平衡向正反应方向移动,提高平衡转化率 Fe-2e-+H2S= FeS+2H+ 生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢
【解析】
(1) ①根据盖斯定律书写总反应的热化学方程式;
②为了提高H2S转化为S的比例,催化转化器中H2S(g)、SO2(g)应恰好完全反应;
(2)根据图示,随温度升高,H2S的平衡转化率增大;相同温度下,利用微波法处理尾气H2S的平衡转化率大。
(3)根据总反应2Fe+2H2S+O2= 2FeS+2H2O,Fe失电子发生氧化反应,所以Fe是负极;从影响反应速率的角度分析单位时间内H2S的去除率降低的原因。
(1) ① 反应Ⅰ:2H2S(g)+3O2(g) =2SO2(g)+2H2O(g) H=-1035.6 kJ·mol1
反应Ⅱ:2H2S(g)+SO2(g) = 3S(g)+2H2O(g) H=-92.8 kJ·mol1
根据盖斯定律Ⅰ×![]() +Ⅱ×
+Ⅱ×![]() 得 2H2S(g)+O2(g) = 2S(g)+2H2O(g) H=-407.1 kJ·mol1;
得 2H2S(g)+O2(g) = 2S(g)+2H2O(g) H=-407.1 kJ·mol1;
②为了提高H2S转化为S的比例,催化转化器中H2S(g)、SO2(g)应恰好完全反应,假设催化转化器中参加反应的H2S(g)的物质的量为2mol,SO2的物质的量是1mol,即反应炉中需要生成1molSO2,反应炉中参加反应的H2S的物质的量为1mol,所以理论上应控制反应炉中H2S的转化率为![]() ;
;
(2) ①根据图示,随温度升高,H2S的平衡转化率增大,说明升高温度,平衡正向移动,正反应为吸热反应;
②根据图示,相同温度下,利用微波法处理尾气H2S的平衡转化率大,所以微波的作用是使H2SH2+S的化学平衡向正反应方向移动,提高平衡转化率;
(3) ①根据总反应2Fe+2H2S+O2= 2FeS+2H2O,Fe发生氧化反应, Fe是原电池负极,负极反应式是Fe-2e-+H2S= FeS+2H+;
②负极生成的FeS附着在铁碳填料的表面,原电池负极的表面积减小,化学反应速率减慢;铁的量因消耗而减少,形成微电池的数量减少,化学反应速率减慢,所以一段时间后,单位时间内H2S的去除率降低。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】砷(![]() )元素广泛的存在于自然界,在周期表中的位置如表。
)元素广泛的存在于自然界,在周期表中的位置如表。
|
| |
|
| |
|
|
完成下列填空:
(1)砷元素最外层电子的排布式为______________。
(2)砷化镓(![]() )和氮化硼(
)和氮化硼(![]() )晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,
)晶体都具有空间网状结构,硬度大。砷化镓熔点为1230℃,![]() 的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
的熔点为3000℃,从物质结构角度解释两者熔点存在差异的原因__________。
(3)亚砷酸盐(![]() )在碱性条件下与碘单质反应生成砷酸盐(
)在碱性条件下与碘单质反应生成砷酸盐(![]() ),完成反应的离子方程式: ____
),完成反应的离子方程式: ____![]() +I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
+I2+_____ ______。该反应是一个可逆反应,说明氧化还原反应的方向和______有关。
(4)工业上将含有砷酸盐(![]() )的废水转化为粗
)的废水转化为粗![]() 的工业流程如下:
的工业流程如下:
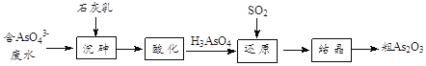
①写出还原过程中砷酸![]() 转化为亚砷酸
转化为亚砷酸![]() 的化学方程式: ___________
的化学方程式: ___________
②“沉砷”是将![]() 转化为
转化为![]() 沉淀,主要反应有:
沉淀,主要反应有:
i.Ca(OH)2(s)Ca2+(aq)+2OH—(aq)+Q
ii.5Ca2++OH—+3![]() Ca5(AsO4)3OH-Q
Ca5(AsO4)3OH-Q
沉砷最佳温度是85℃。用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据《科技日报》报道,我国科学家研制成功一系列石墨烯限域的3d过渡金属中心(Mn、Fe、Co、Ni、Cu)催化剂。请回答下列问题:
(1)基态Ni原子价层电子的轨道表达式为__________________。
(2)铜的焰色反应呈绿色,在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为_____。
(3)![]() 因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与
因具有良好的结构稳定性而成为新一代锂离子电池正极材料,这与![]() 的结构密切相关,
的结构密切相关,![]() 的立体构型为________,P、O、S的电负性从大到小的顺序为_____,
的立体构型为________,P、O、S的电负性从大到小的顺序为_____,![]() 过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是_____(填标号)。
A. B.
B.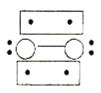 C.
C.![]() D.
D.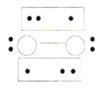
(4)![]() 易与
易与![]() 结合形成
结合形成![]() ,
,![]() 与
与![]() 间的化学键类型为________,若将配离子
间的化学键类型为________,若将配离子![]() 中的2个
中的2个![]() 换为
换为![]() ,2种结构,则
,2种结构,则![]() 是否为
是否为![]() 杂化________(填“是”或“否”),理由为_________________。
杂化________(填“是”或“否”),理由为_________________。
(5)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm。
的结构为体心立方堆积,晶胞参数为apm。![]() 中锰的原子半径为________pm。已知阿伏加德罗常数的值为
中锰的原子半径为________pm。已知阿伏加德罗常数的值为![]() ,
,![]() 的理论密度
的理论密度![]() ________
________![]() 。(列出计算式)
。(列出计算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列反应:
①Fe+CuSO4=Cu+FeSO4
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4 =BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)反应①中,氧化剂是______________________。
(2)反应③的离子反应方程式为_________________________________________。
(3)写出一个符合⑧的化学反应方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯甲醚是我国CB2760-86规定为允许使用的食用香料。常用于烘烤食品、软糖、冰冻乳制品。根据以下与其有关的合成有机物H的路线,回答问题。
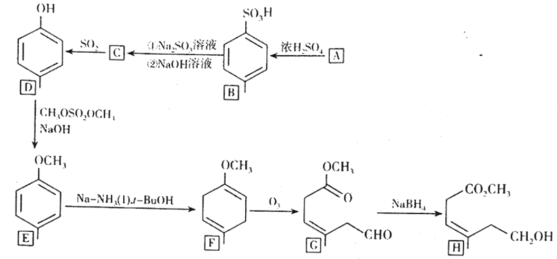
(1) 有机物A的名称是___,有机物C的结构简式是___。()
(2) E→F的反应类型是___,F→G的反应类型是___。
(3) 已知G→H的反应过程是,G先与NaBH4以物质的量比4:1发生加成反应,然后再水解生成H以及钠和硼的氢氧化物,则G→H的总化学方程式为___。
(4) 能与FeCl3溶液发生显色反应的E的同分异构体中,其苯环上的一氯取代物最多有___种。
(5) 已知 ,请结合题中信息设计由
,请结合题中信息设计由![]() 合成
合成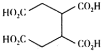 的合成路线(其他试剂任选):___。
的合成路线(其他试剂任选):___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上应用两矿法浸出软锰矿(主要成分MnO2)和方铅矿(主要成分PbS、FeS2),制备PbSO4和Mn3O4,转化流程如下。
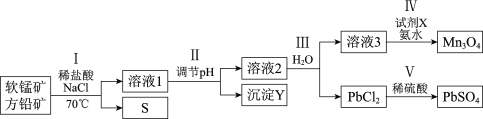
已知:PbCl2微溶于水,溶液中存在可逆反应:![]() 。
。
下列说法正确的是
A.Ⅰ中可使用浓盐酸代替稀盐酸和NaCl的混合溶液
B.Ⅱ中生成的沉淀Y是Fe(OH)2
C.Ⅳ中试剂X可能作氧化剂
D.Ⅴ中发生反应:Pb2++SO42-== PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂皮是肉桂树的树皮,常被用作药物和食用香料,有效成分为肉桂醛。从肉桂皮中提取肉桂醛的主要流程如下:

下列说法不正确的是
A.肉桂醛可用作食品添加剂且不应过量
B.肉桂醛可溶于乙醇
C.红外光谱可检测出肉桂醛分子中含有碳碳双键和醛基
D.肉桂醛长期置于空气中容易发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式不正确的是
A.硫酸铝溶液中加入氢氧化钡溶液:Ba2++![]() == BaSO4↓
== BaSO4↓
B.硫酸亚铁溶液中加入过氧化氢溶液:2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O
C.向NaHCO3 溶液中加入NaOH溶液:![]() + OH-==
+ OH-==![]() + H2O
+ H2O
D.向AgCl悬浊液中加入Na2S溶液:2AgCl + S2-== Ag2S + 2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成氨反应的能量变化如图所示,该反应的热化学方程式是
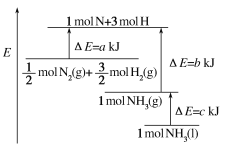
A. N2(g)+3H2(g)=2NH3(l) ΔH=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g) ΔH=2(b-a)kJ·mol-1
C. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
H2(g)=NH3(l) ΔH=(b+c-a)kJ·mol-1
D. ![]() N2(g)+
N2(g)+![]() H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
H2(g)=NH3(g) ΔH=(a+b)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com