
【题目】工业上应用两矿法浸出软锰矿(主要成分MnO2)和方铅矿(主要成分PbS、FeS2),制备PbSO4和Mn3O4,转化流程如下。
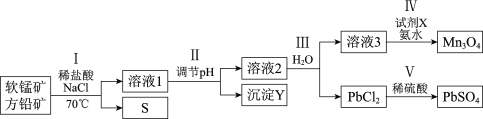
已知:PbCl2微溶于水,溶液中存在可逆反应:![]() 。
。
下列说法正确的是
A.Ⅰ中可使用浓盐酸代替稀盐酸和NaCl的混合溶液
B.Ⅱ中生成的沉淀Y是Fe(OH)2
C.Ⅳ中试剂X可能作氧化剂
D.Ⅴ中发生反应:Pb2++SO42-== PbSO4
【答案】C
【解析】
方铅矿 (主要成分PbS、、FeS2)和软锰矿(主要成分MnO2)中加入稀盐酸、NaCl溶液并加热至70℃,发生的反应有MnO2+PbS+4HCl=MnCl2+PbCl2+S+ 2H2O,3MnO2+2FeS2+12HCl=3MnCl2+2FeCl3+4S+6H2O,调节溶液的pH使铁离子和转化为沉淀,要除去这两种离子需要加入碱性物质且不能引进新的杂质,然后过滤得到氢氧化铁沉淀和滤液,将溶液蒸发浓缩、冷却结晶、过滤得到PbCl2晶体和滤液,向滤液中通入氨气、X使锰离子被氧化生成Mn3O4,将溶液过滤得到Mn3O4和滤液,据此解答。
A.若用浓盐酸代替稀盐酸和NaCl的混合溶液,那么浓盐酸与软锰矿中的MnO2反应生成氯气,A错误;
B.由分析可知Ⅱ中生成的沉淀Y是Fe(OH)3,B错误;
C.Ⅳ中向滤液中通入氨气、X使锰离子被氧化生成Mn3O4,则试剂X可能作氧化剂,C正确;
D.因为PbCl2微溶于水,溶液中存在可逆反应:![]() ,故Ⅴ中发生反应:PbCl42-+SO42-== PbSO4+4Cl-,D错误;
,故Ⅴ中发生反应:PbCl42-+SO42-== PbSO4+4Cl-,D错误;
故选C。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
【题目】实验室用8.7g的MnO2与50mL足量的浓盐酸制取氯气,其反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(1)求生成氯气的体积(标准状况)______________
(2)若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
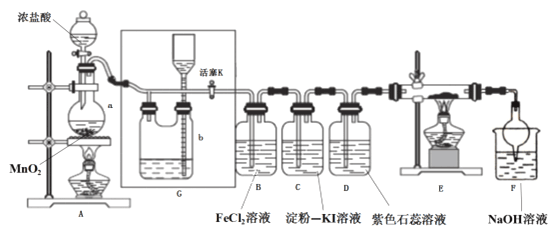
(1)A中发生反应的化学反应方程式为________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置C、D中能看到的实验现象分别是 ________ 、________;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为_________;
③装置F中球形干燥管的作用是__________;
(3)储气瓶b内盛放的试剂是___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油加氢精制和天然气净化等过程产生有毒的H2S,直接排放会污染空气。
(1)工业上用克劳斯工艺处理含H2S的尾气获得硫黄,流程如下:
![]()
①反应炉中的反应:2H2S(g)+3O2(g) =2SO2(g)+2H2O(g) H=-1035.6 kJ·mol1
催化转化器中的反应:2H2S(g)+SO2(g) = 3S(g)+2H2O(g) H=-92.8 kJ·mol1
克劳斯工艺中获得气态硫黄的总反应的热化学方程式:______。
②为了提高H2S转化为S的比例,理论上应控制反应炉中H2S的转化率为______。
(2)科研工作者利用微波法处理尾气中的H2S并回收H2和S,反应为:H2S![]() H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
H2+S,一定条件下,H2S的转化率随温度变化的曲线如图。
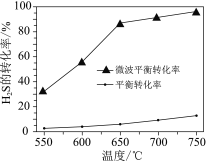
①H2S分解生成H2和S的反应为______反应(填“吸热”或“放热”)。
②微波的作用是______。
(3)某科研小组将微电池技术用于去除天然气中的H2S,装置示意图如下,主要反应:2Fe+2H2S+O2= 2FeS+2H2O(FeS难溶于水),室温时,pH=7的条件下,研究反应时间对H2S的去除率的影响。

①装置中微电池负极的电极反应式:______。
②一段时间后,单位时间内H2S的去除率降低,可能的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:“氨气可在纯氧中安静燃烧……”。某校化学兴趣小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验对比。
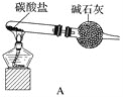
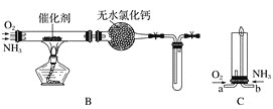
(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是____________________;碱石灰的作用是__________________________。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式__________________;试管内气体变为红棕色,该反应的化学方程式是_______________________。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因________________________。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是_____________,其理由是______________________。
②氨气燃烧的化学方程式是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10 mL充满NO2和O2的混合气体的试管,倒置在水槽中,反应停止后试管内剩余2 mL的无色气体,求原混合气体中NO2和O2各多少毫升____________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场酒精检测,下列说法不正确的是
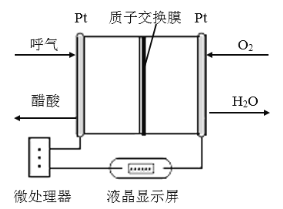
A.电流由O2所在的铂电极经外电路流向另一电极
B.该电池的正极反应式为:O2 + 4e- + 4H+=2H2O
C.该电池的负极反应式为:CH3CH2OH + 3H2O-12e-=2CO2↑ + 12H+
D.微处理器通过检测电流大小而计算出被测气体中酒精的含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 具有净水作用,但腐蚀设备,工业上常用电浮选凝聚法处理污水。其原理是保持污水的
具有净水作用,但腐蚀设备,工业上常用电浮选凝聚法处理污水。其原理是保持污水的![]() 在
在![]() 之间,通过电解生成
之间,通过电解生成![]() ,沉淀。若阳极同时发生两个电极反应,其中一个反应生成一种无色气体,下列叙述不正确的是( )
,沉淀。若阳极同时发生两个电极反应,其中一个反应生成一种无色气体,下列叙述不正确的是( )
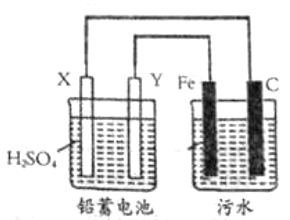
A.![]() 为金属
为金属![]() ,
,![]() 为
为![]()
B.电解池阳极的一个反应为:![]()
C.污水中生成![]() 的反应为:
的反应为:![]()
D.为增强污水导电能力,加快污水处理效果,可向污水中加入过量的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com