
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90 ℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液:________;NH4Cl溶液:________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),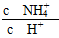 ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
| 阳离子 | Na+ Al3+ Fe3+ Cu2+、 Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
 ’
’查看答案和解析>>
科目:高中化学 来源: 题型:填空题
为了证明一水合氨(NH3·H2O)是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
0.010 mol·L-1氨水、0.1 mol·L-1 NH4Cl溶液、NH4Cl晶体、酚酞试液、pH试纸、蒸馏水。
(1)甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填“正确”或“不正确”),并说明理由 。
(2)乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b应满足什么关系? 。
(3)丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入少量NH4Cl晶体,溶液颜色变 (填“深”或“浅”)。你认为这一方法能否证明NH3·H2O是弱电解质? (填“能”或“否”),并说明原因 。
(4)请你根据所提供的试剂,再提出一个合理又简便的方案证明NH3·H2O是弱电解质: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用实验确定某酸HA是弱电解质。甲、乙两同学的方案是:
甲:①称取一定质量的HA配制0.1 mol/L的HA溶液100 mL;②用pH试纸测出该溶液的pH,即能证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸,分别配制pH=1的两种酸溶液各100 mL;②分别取这两种溶液各10 mL,加水稀释至100 ml;③各取相同体积的两种稀释液装入两个试管中,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)甲方案中,说明HA是弱电解质的理由是测得溶液的pH________1(填“>”“<”或“=”),乙方案中,说明HA是弱电解质的现象是________(填序号)。
a.装盐酸的试管中放出H2的速率快
b.装HA溶液的试管中放出H2的速率快
c.两个试管中产生气体的速率一样快
(2)请你评价乙方案中难以实现之处和不妥之处________。
(3)请你再提出一个合理而比较容易进行的方案(药品可任用),请表述实验方案:________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________;NH4Cl溶液________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________(填“增大”、“减小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。已知:
SrSO4(s)  Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s)  Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是___________________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是某研究性学习小组设计的对一种废旧合金的各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。
已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38, Ksp[Mn(OH)2] =1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中可能涉及的化学方程式: 。
(3)过量的还原剂应是 。
(4)①向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为 。
②若用X mol/L KMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液YmL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: ﹥ ﹥ 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为Z g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L(用含Z的代数式表示);该电极的反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺流程如下: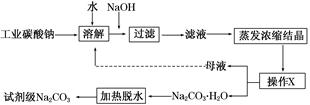
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示: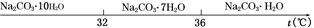
Ⅱ.有关物质的溶度积如下:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某二元酸(化学式用H2B表示)在水中的电离方程式是H2B===H++HB-;HB- H++B2-。回答下列问题。
H++B2-。回答下列问题。
(1)Na2B溶液显_____(填“酸性”、“中性”或“碱性”),理由是_______(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2B溶液中,下列粒子浓度关系式正确的是____。
A.c(B2-)+c(HB-)+c(H2B)=0.1 mol·L-1
B.c(Na+)+c(OH-)=c(H+)+c(HB-)
C.c(Na+)+c(H+)=c(OH-)+c(HB-)+2c(B2-)
D.c(Na+)=2c(B2-)+2c(HB-)
(3)已知0.1 mol·L-1 NaHB溶液的pH=2,则0.1 mol·L-1 H2B溶液中的氢离子的物质的量浓度可能____0.11 mol·L-1(填“<”、“>”或“=”),理由是_____。
(4)0.1 mol·L-1 NaHB溶液中各种离子浓度由大到小的顺序是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com