
����Ŀ����.�������а������ʣ���ʳ�ξ��壻���Ҵ����۱����ᣨ�����ᾧ�壩����NaHSO4����KNO3��Һ�������ڵ��������ƣ���Һ̬�Ȼ��⣻��Cl2��
��1����ջش����������
a�������������ڷǵ���ʵ���______��
b���������ʿ��Ե������________��
��2��д��������ˮʱ�ĵ��뷽��ʽ________��
��.��Ҫ��ش���������:
��1����������CO2��CO����������ķ�����֮��Ϊ_____��
��2��ʵ������ʢ������������Һ���Լ�ƿƿ�������ò������������ӷ���ʽ��ʾ���е�ԭ��_____��
��3���ҹ�����Ϊ��������ȱ�������涨��ʳ���б�����������ĵ���ء�����ʳ�����Ƿ�ӵ⣬���������·�Ӧ��KIO3 +KI+H2SO4 = K2SO4+ I2+H2O��
�ٽ�����������ԭ��Ӧ�Ļ�ѧ����ʽ��ƽ___��
�������Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ_______mol��
���𰸡��� �ݢ� NaHSO4=Na++H++SO42- 7:11 SiO2+2OH-=SiO32-+H2O 1��5��3��3��3��3 0.3mol
��������
���ʳ�ξ������ڵ���ʣ����ܵ��磻���Ҵ����ڷǵ���ʣ����ܵ��磻�������ᣨ�����ᾧ�壩���ڵ���ʣ����ܵ��磻��NaHSO4���ڵ���ʣ����ܵ��磻��KNO3��Һ���ڵ������Һ���ܵ��磻�����ڵ������������ڵ���ʣ��ܵ��磻��Һ̬�Ȼ������ڵ���ʣ����ܵ��磻��Cl2���ǵ����Ҳ���Ƿǵ���ʣ����ܵ��磻�ó����ۡ�
��������ˮʱ�ĵ��뷽��ʽ��NaHSO4 = Na++H++SO42����
���ŵ�������CO2��CO��������֮�ȵ������ʵ���֮�ȣ�![]() ��������ȣ����ʵ�����Ħ�������ʷ��ȣ�
��������ȣ����ʵ�����Ħ�������ʷ��ȣ�![]() �������������ķ�����֮��Ϊ7:11��
�������������ķ�����֮��Ϊ7:11��
��ʵ������ʢ������������Һ���Լ�ƿƿ�������ò��������������Ͷ������跴Ӧ���ɹ������ˮ��
����KIO3�е⻯�ϼ۽���5�ۣ�KI�е⻯�ϼ�����1�ۣ����������غ������ƽ��KIO3 +5KI+3H2SO4 =3 K2SO4+3I2+3H2O��
����Ӧ����ʽת��5mol���ӣ�����3mol���ʵ⣬��˷�Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ0.3mol��
���ʳ�ξ������ڵ���ʣ����ܵ��磻���Ҵ����ڷǵ���ʣ����ܵ��磻�������ᣨ�����ᾧ�壩���ڵ���ʣ����ܵ��磻��NaHSO4���ڵ���ʣ����ܵ��磻��KNO3��Һ���ڵ������Һ���ܵ��磻�����ڵ������������ڵ���ʣ��ܵ��磻��Һ̬�Ȼ������ڵ���ʣ����ܵ��磻��Cl2���ǵ����Ҳ���Ƿǵ���ʣ����ܵ��硣
��a�������������ڷǵ���ʵ�������b���������ʿ��Ե�������ݢ����ʴ�Ϊ�������ݢ���
��������ˮʱ�ĵ��뷽��ʽ��NaHSO4 = Na++H++SO42�����ʴ�Ϊ��NaHSO4 = Na++H++SO42����
���ŵ�������CO2��CO��������֮�ȵ������ʵ���֮�ȣ�![]() ��������ȣ����ʵ�����Ħ�������ʷ��ȣ�
��������ȣ����ʵ�����Ħ�������ʷ��ȣ�![]() �������������ķ�����֮��Ϊ7:11���ʴ�Ϊ��7:11��
�������������ķ�����֮��Ϊ7:11���ʴ�Ϊ��7:11��
��ʵ������ʢ������������Һ���Լ�ƿƿ�������ò��������������Ͷ������跴Ӧ���ɹ������ˮ�����ӷ���ʽ��ʾ���е�ԭ��SiO2+2OH-=SiO32��+H2O���ʴ�Ϊ��SiO2+2OH-=SiO32��+H2O��
����KIO3�е⻯�ϼ۽���5�ۣ�KI�е⻯�ϼ�����1�ۣ����������غ������ƽ��KIO3 +5KI+3H2SO4 =3 K2SO4+3I2+3H2O���ʴ�Ϊ��1��5��3��3��3��3��
����Ӧ����ʽת��5mol���ӣ�����3mol���ʵ⣬��˷�Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ0.3mol���ʴ�Ϊ��0.3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ��̽��ij��ʯ���������ֶ�����Ԫ�أ�����ɺ����ʣ���֪��ʯ����һ���Ľᾧˮ��
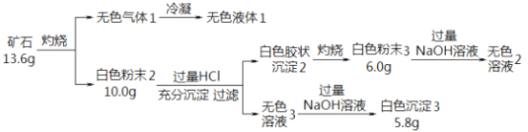
��1����ʯ�����Ԫ���� H��O ��_____�� ______����Ԫ�ط��ţ�����ѧʽΪ_____________��
��2����ɫ��ĩ3 ����NaOH��Һ�����ӷ���ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ�����ֱ����Ũ�ȡ�������Ĺ���ϡ���ᷴӦ��������������(V)��ʱ��(t)�Ĺ�ϵ����ͼ��ʾ����Ӧ��þ������(����)

A. ���ʵ���֮��Ϊ3��2 B. ����֮��Ϊ3��2
C. Ħ������֮��Ϊ2��3 D. ʧȥ�ĵ�����֮��Ϊ8��9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧС��ģ��ʪ�������������ӡˢ��·�徭�ܽ⡢��ȡ�����Ȳ�������ͭ����ȡ���������̼�ͼ���£�

��֪ͭ����Һ��ͭԪ����[Cu(NH3)4]2+��ʽ���ڡ�
�����й�˵����ȷ����
A.��Ӧ����H2O2�������ǻ�ԭ���������ٵ������ǹ���
B.�����ں͢��õ�����Ҫ�������Ƿ�Һ©�������в����ڵ�Ŀ��������![]() ��ˮ�е��ܽ��
��ˮ�е��ܽ��
C.�������Ǽ�����������ۣ����ˣ������ݵ���Ҫ����������Ũ������ȴ�ᾧ������
D.�����п�ѭ��ʹ�õ��Լ���NH4Cl���л��ܼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС�����Ӻ������������P����FeS��SiO2�������з�����������貢�Ʊ��̷���FeSO4��7H2O�����壬ʵ��������£�

��֪��һ�������¹��������������������Һ����ش�
��1��������У��Լ�XӦ����________��
��2���Ʊ��̷�ʱ������Һ1�м�������Լ�Y����ַ�Ӧ��________�����õ���Һ2��
��3����Ƽ�ʵ�鷽����֤����ڵõ���SiO2�����в���S________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ������ɹ��ϳ������������嵪��������(N5)6(H3O)3(NH4)4Cl����R���������ش��������⣺
��1����ԭ�Ӽ۲���ӵĹ������ʽ�������Ų�ͼ��Ϊ___��
��2��Ԫ�صĻ�̬��̬ԭ�ӵõ�һ�������γ���̬��һ������ʱ���ų�������������һ�������ܣ�E1�����ڶ����ڲ���Ԫ�ص�E1�仯������ͼ��a����ʾ�����г���Ԫ���⣬����Ԫ�ص�E1����������������ԭ����___����Ԫ�ص�E1�����쳣��ԭ����___��
��3����X���������û�����R�ľ���ṹ����ֲ��ṹ��ͼ��b����ʾ��
�ٴӽṹ�Ƕȷ�����R�����������ӵ���֮ͬ��Ϊ___����֮ͬ��Ϊ____�������ţ�
A������ԭ�ӵ��ӻ�������� B������ԭ�ӵļ۲���Ӷ���
C������ṹ D�����ۼ�����
��ͼ��b�������ߴ�����������ʾʽΪ��NH4+��N-H��Cl��____��____��

��4��R�ľ����ܶ�Ϊd g��cm-3����������������Ϊanm�������к���y��[(N5)6(H3O)3(NH4)4Cl]��Ԫ���õ�Ԫ���������ΪM����y�ļ������ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������й���Һ���������ʵ���Ũ�ȹ�ϵ����ȷ���ǣ� ��
A.0.1mol��L��1 CH3COONa��Һ��0.1mol��L��1 HCl��Һ�������ϣ�c(Na+)=c(Cl��)>c(H+)>c(CH3COO��)
B.0.1mol��L��1NH4Cl��Һ��0.1mol��L��1��ˮ�������ϣ�pH>7����c(NH4+)>c(Cl��)>c(NH3��H2O)>c(OH��) >c(H+)
C.0.1mol��L��1Na2CO3��Һ��0.1mol��L��1NaHCO3��Һ�������ϣ�2c(Na+)=3[c(CO32��)��c(HCO3��)��c(H2CO3)]
D.0.1mol��L��1Na2C2O4��Һ��0.1mol��L��1 HCl��Һ�������ϣ�H2C2O4Ϊ��Ԫ���ᣩ��2c(C2O42��)��c(HC2O4��)��c(OH��)=c(Na+)��c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������A�Ǻϳ���Ȼ�ĵ��壬����ʽΪC5H8��A��һϵ�з�Ӧ����(���ַ�Ӧ������ȥ)��

��֪��
�ش��������⣺
(1)A�Ľṹ��ʽΪ_____________����ѧ������________________________��
(2)B�ķ���ʽΪ__________________________��
(3)�ڷ�Ӧ�Ļ�ѧ����ʽΪ_____________________________________��
(4)�ٺ͢۵ķ�Ӧ���ͷֱ���___________��______________��
(5)CΪ�������������������Ǽ����ܵĻ�ѧ����ʽ��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ���������ȷ���ǣ���
A.������ˮ��Al3++3H2O![]() Al(OH)3��+3H+
Al(OH)3��+3H+
B.�Ȼ������ˮ��NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.��������Һ�У�H2SO3![]() 2H++SO32-
2H++SO32-
D.��С�մ���Һ�еμ��������ƣ�HCO3��+OH��=CO2��+H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com