
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是( )
A.0.1mol·L-1 CH3COONa溶液与0.1mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)
B.0.1mol·L-1NH4Cl溶液与0.1mol·L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-) >c(H+)
C.0.1mol·L-1Na2CO3溶液与0.1mol·L-1NaHCO3溶液等体积混合:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.0.1mol·L-1Na2C2O4溶液与0.1mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
【答案】D
【解析】
A.0.1molL-1CH3COONa溶液与HCl溶液等体积混合生产等物质的量的醋酸和氯化钠,醋酸是弱电解质存在电离平衡,且电离程度较小,水也要电离出部分氢离子,则c(Na+)═c(Cl-)>c(H+)>c(CH3COO-),故A正确;
B.0.1molL-1NH4Cl溶液与0.1molL-1氨水等体积混合后溶液的pH>7,溶液显碱性,说明一水合氨电离程度大于铵根离子的水解程度,则c(NH4+)>c(Cl-) >c(NH3·H2O) >c(OH-) >c(H+),故B正确;
C.0.1molL-1Na2CO3溶液与0.1molL-1NaHCO3溶液等体积混合,溶液中存在物料守恒:![]() c(Na)═c(CO32-)+c(HCO3-)+c(H2CO3),即2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故C正确;
c(Na)═c(CO32-)+c(HCO3-)+c(H2CO3),即2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故C正确;
D.0.1molL-1Na2C2O4溶液与0.1molL-1HCl溶液等体积混合生成等浓度的氯化钠和草酸氢钠溶液,溶液中存在电荷守恒,2c(C2O42-)+c(HC2O4-)+c(OH-)+(Cl-)═c(Na+)+c(H+),故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】为验证Cl2、Fe3+、I2三者氧化性的相对强弱,某小组用图所示装置进行实验(夹持仪器已略去,气密性已检验)。
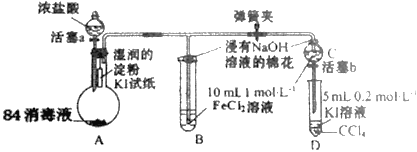
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C 中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,一段时间后,B 中溶液红色加深,关闭活塞a。
Ⅳ……
(1)盛浓盐酸溶液的仪器名称是__;A中产生黄绿色气体,写出A中发生反应的离子方程式__。
(2)验证氯气的氧化性强于碘单质的实验现象是__。
(3)B中溶液发生的离子方程式__。
(4)为验证Fe3+的氧化性强于碘单质,过程Ⅳ的操作和现象是__,对应反应的离子方程式是__。
(5)浸有氢氧化钠溶液的棉花作用是__。
(6)过程Ⅲ实验的目的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:
2CH3COOH。现以A为主要原料合成化合物E,其合成路线如图1所示。回答下列问题:

(1)写出下列物质的官能团名称:B:____________________;D:____________________。
(2)反应④的化学方程式为________________________________________________,反应类型:________。
(3)某学习小组设计物质B催化氧化的实验装置如下,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体药品可能为________(填字母)。
A.Na2O2 B.KClC.Na2CO3 D.MnO2
②实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_______________________________。
③物质B的催化氧化产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有下列八种物质:①食盐晶体;②乙醇;③冰醋酸(纯醋酸晶体);④NaHSO4;⑤KNO3溶液;⑥熔融的氢氧化钠;⑦液态氯化氢;⑧Cl2。
(1)填空回答(填序号):
a、以上物质属于非电解质的是______。
b、以上物质可以导电的是________。
(2)写出④溶于水时的电离方程式________。
Ⅱ.按要求回答下列问题:
(1)等质量的CO2和CO:所含气体的分子数之比为_____;
(2)实验室里盛放氢氧化钠溶液的试剂瓶瓶塞不能用玻璃塞,用离子方程式表示其中的原因_____;
(3)我国政府为了消除碘缺乏病,规定在食盐中必须加人适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:KIO3 +KI+H2SO4 = K2SO4+ I2+H2O。
①将上面氧化还原反应的化学方程式配平___。
②如果反应中转移0.5mol电子,则生成I2的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列问题:
(1)某元素原子共有3个价电子,其中一个价电子位于第三能层d轨道,试回答:该元素核外价电子排布图___,电子排布式_____。
(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:____、____、____。
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子。____
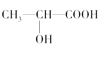
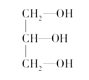
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)____。
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4____H2SO3;HClO3____HClO4;H3PO4___H3PO3。
(6)根据价层电子对互斥理论判断下列问题:
NH3中心原子的杂化方式为___杂化,VSEPR构型为__,分子的立体构型为____。
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碳酸钠和碳酸氢钠的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g。回答下列问题:
(1)若取等质量的原混合物溶于水,配成80mL溶液,则c(Na+) = ______mol·L-1;
(2)向(1)所配溶液中逐滴滴加1mol·L-1的稀盐酸至过量,生成的CO2体积(标准状况下)与加入的盐酸体积有如下图关系(不考虑CO2在水中的溶解),则a点消耗盐酸的体积为_______mL。
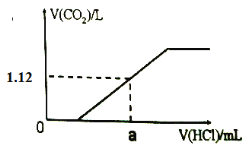
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰(CN)2、硫氰(SCN)2等称为拟卤素,它们与卤素单质性质相似,它们的阴离子也与卤素阴离子性质相似。例如:2Fe+3(SCN)2==2Fe(SCN)3、Ag++CN-== AgCN↓(白)。拟卤素形成的无氧酸和含氧酸一般比氢卤酸和次卤酸弱,阴离子的还原性一般比Br-强。下列反应中,不正确的是( )
A. 2CN-+Cl2= 2Cl-+(CN)2
B. (CN)2+2OH-=CN-+CNO-+H2O
C. (SCN)2+H2O = 2H++SCN-+SCNO-
D. MnO2+4HSCN(浓)![]() (SCN)2↑+Mn(SCN)2+2H2O
(SCN)2↑+Mn(SCN)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室产生的废液中含有 Fe3+、Cu2+、Ag+三种金属离子,甲同学设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。据此分析,下列说法正确的是( )
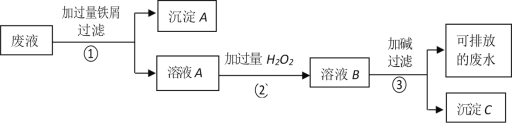
A. 沉淀 A 中含有 2 种金属单质
B. 可用 KSCN 溶液来检验溶液 B 中所含的金属离子
C. 溶液 A 若只经过操作③最终将无法得到沉淀 C
D. 操作①②③中都需要用到玻璃棒、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氯化铝溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
B.铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑
C.向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-
D.向明矾溶液中加入氢氧化钡溶液至SO42-恰好沉淀:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com