
【题目】中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。
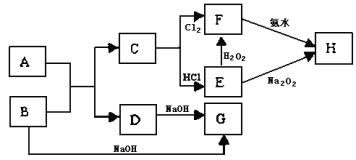
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围____;
(2)写出H2O2的电子式:____;
(3)写出B→G的离子方程式____;
(4)若A、B恰好完全反应,将产物C与足量盐酸反应得到amol气体,另取等质量B与足量盐酸反应得到b mol气体,a:b=5:7,则A的化学式为___。
【答案】1100nm ![]() 2Al+2OH+2H2O=2AlO2+3H2↑ Fe5O7
2Al+2OH+2H2O=2AlO2+3H2↑ Fe5O7
【解析】
已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体,则H为Fe(OH)3,C+Cl2→F,判断F为FeCl3,C为Fe,E和过氧化氢反应生成F,说明E为FeCl2,转化关系中的B、D都和氢氧化钠反应,A+B=C+D是金属置换铁的置换反应,判断为A为铁氧化物,B为Al,D为Al2O3,G为NaAlO2,结合对应物质的性质以及题目要求解答该题。
(1)胶体粒子直径介于1100nm;
(2)H2O2的电子式为:![]() ;
;
(3)②B→G的反应为铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;反应的离子方程式为2Al+2OH+2H2O=2AlO2+3H2↑;
(4)A、B恰好完全反应后,将产物铁与足量盐酸反应得到a mol气体,根据转移电子守恒知铁的物质的量=氢气的物质的量=amol,若将反应前的铝与足量NaOH溶液反应,可得到b mol气体,2Al→3H2,根据转移电子守恒知铝的物质的量=![]() bmol,且a:b=5:7,设铁的化合价为x,根据转移电子守恒:
bmol,且a:b=5:7,设铁的化合价为x,根据转移电子守恒:![]() b mol×(3-0)= a mol×(x-0),则x=+
b mol×(3-0)= a mol×(x-0),则x=+![]() ,则A的化学式为Fe5O7。
,则A的化学式为Fe5O7。


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
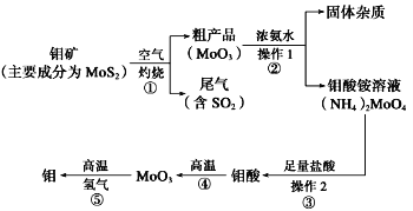
(1)写出在高温下发生反应①的化学方程_____
(2)生产中用足量的浓氨水吸收反应①的尾气合成肥料,写出该反应的离子方程式:___
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有_____
(4)某同学利用如图所示装置来制备氢气,利用氢气还原三氧化钼,根据要求回答问题:

①步骤⑤的化学反应方程式为___。请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是____。
②在烧瓶A中加入少量硫酸铜的目的是__
③两次使用D装置,其中所盛的药品依次是_____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
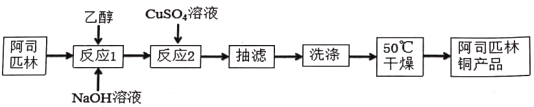
【题目】阿司匹林铜具有很强的抗炎作用。它是一种亮蓝色结晶粉末,不溶于水、醇、醚及氯仿等溶剂中。易受热分解成浅绿色混合物。在强酸条件下能解离出铜离子。合成阿司匹林铜,其实验流程如下:
已知反应方程式如下:
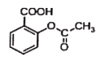 +NaOH→
+NaOH→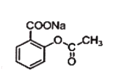 +H2O
+H2O
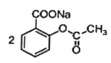 +CuSO4→
+CuSO4→ +Na2SO4
+Na2SO4
(1)下列有关说法正确的是_____。
A.反应1中加乙醇作溶剂,目的是增大接触面积,加快反应速率
B.用倾析法将反应2中的液体和沉淀同时转移到布氏漏斗中进行抽滤
C.洗涤操作中,可先用水洗2-3次,再用酒精洗涤2-3次
D.干燥后发现固体呈浅绿色,可能是烘干温度过高造成的结果
(2)反应1中的反应温度要求控制在室温的理由是______。
(3)阿司匹林铜中铜含量的测定,可用碘量法测定:
步骤一:准确称取0.800g样品,置于250mL锥形瓶中,加4mL3.00mol/L,再加20mL水,加热煮沸,样品完全分解后,摇匀,冷却到室温。
步骤二:往溶液中加入1.200gKI摇匀,用0.100mol/LNa2S2O3标准溶液滴定至溶液变浅黄色时,加入10mL 10% KSCN试剂,并加几滴淀粉溶液,继续用0.100mol/LNa2S2O3标准溶液滴定至终点,共消耗溶液体积为23.00mL。
已知:CuI难溶于水,能吸附碘;I2+2S2O32-=S4O62-+2I-。
CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①实验中加入10mL 10%KSCN试剂的目的是______。
②上述测定实验中,继续滴加Na2S2O3标准溶液至终点的具体实验操作______。
③该样品中的铜含量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学、环境保护和人类健康是息息相关的三个主题,请根据已知信息回答有关问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是________(填序号)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl→CH3CH2Cl+H2O
C.CH3CH3+Cl2![]() CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2![]() CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性高的是________反应(填反应类型)。
(2)有毒物质的无害化也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,还可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性酸根离子氧化除去。请写出用ClO2将废水中有剧毒的CN-氧化成无毒气体的离子方程式:____________________并说明该方法的优点:_____________________________________。
(3)如图为某饮用水厂从天然水制备纯净水(去离子水)的工艺流程示意图:
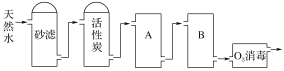
活性炭的作用是____________________;用O3消毒的优点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.9g超重水(3H216O)含中子数为6NA
B.标准状况下,22.4L CCl4含有的分子数目为NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.一定条件下,将1mol N2和3mol H2混合,充分反应后转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚(CH3OCH3)和甲醇(CH3OH)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。以CH4和H2O为原料制备二甲醚和甲醇的工业流程如图:
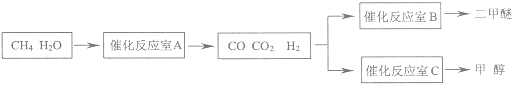
(1)催化反应室B中CO与H2合成二甲醚的化学方程式为___。
(2)催化反应室A中发生的反应为:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)……(Ⅰ)
CO(g)+3H2(g)……(Ⅰ)
CO(g)+H2O(g)![]() CO2(g)+H2(g)……(Ⅱ)
CO2(g)+H2(g)……(Ⅱ)
催化反应室C中发生的反应为:
CO(g)+2H2(g)![]() CH3OH(g)……(Ⅲ)
CH3OH(g)……(Ⅲ)
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)……(Ⅳ)
CH3OH(g)+H2O(g)……(Ⅳ)
①已知:原子利用率=![]() ×100%。试求反应(Ⅳ)的原子利用率为___。
×100%。试求反应(Ⅳ)的原子利用率为___。
②反应(Ⅳ)的△S___0(填“>”、“=”或“<”)。
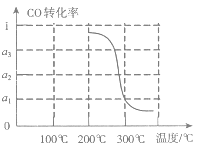
③在压强为5MPa,体积为V L的反应室c中,a mol CO与2a mol H2在催化剂作用下发生反应(Ⅲ)生成甲醇,CO的转化率与温度的关系如图。则该反应的△H___0(填“>”、“=”或“<”)。300℃时该反应的平衡常数K=___(用含字母的代数式表示)。
(3)我国某科研所提供一种碱性“直接二甲醚燃料电池”。该燃料电池负极的电极反应式为:CH3OCH3-12e-+16OH-=2CO32-+11H2O。有人提出了一种利用氯碱工业产品治理含二氧化硫(体积分数为x)废气的方法如下:
①将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液;
②将电解饱和食盐水所得气体反应后制得盐酸;
③将盐酸加入 NaHSO3溶液中得SO2气体回收。
用上述碱性“直接二甲醚燃料电池”电解食盐水来处理标准状况下V L的废气,计算消耗二甲醚的质量___。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素如Fe、Mn、Cu、Ni可用作很多反应的催化剂,在室温下以H2O2为氧化剂直接将CH4氧化,回答下列问题:
(1)基态铜原子的核外电子排布式是___,第四周期元素中,基态原子未成对电子数最多的元素是____(填元素符号)
(2)C、H、O、Fe四种元素的电负性由大到小的顺序是____
(3)常温下,H2O2氧化CH4生成CH3OH、HCHO等
①CH3OH和HCHO的沸点分别是64.7℃、-19.5℃,其主要原因是____
②CH4、HCHO的键角较大的是___,原因是______
(4)Cu2+可与乙二胺(NH2CH2CH2NH2,简写为en)形成配合物,化学式为Cu(en)22+,乙二胺中与Cu2+形成配位键的原子是___(填元素符号),该配合物的配位数是__
(5)Cu晶胞结构如图所示,已知铜原子半径为apm,阿伏加德罗常数用NA表示,则铜晶体的密度为____g/cm3(写出计算表达式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答:

(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是____。
(2)写出碳酸氢铵中阳离子的检验方法______________________________。
(3)写出工业上合成③的化学方程式__________________________________。
(4)⑧与⑨反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲配制480 mL物质的量浓度为0.1mol·L-1的CuSO4溶液。
(1)完成该实验用到的仪器主要有:托盘天平、胶头滴管、烧杯、玻璃棒、药匙和____________。
(2)写出整个实验简单的操作过程:计算→称量→溶解→转移→____________→定容→摇匀。
(3)如果用CuSO4固体来配制,应该称量固体的质量为_________________;如果用CuSO4·5H2O来配制,应该称量固体的质量为____________________。
(4)下列操作使配制的溶液浓度偏低的是__________________。
A.配制的过程中有少量的液体溅出烧杯。
B.使用前容量瓶用蒸馏水洗涤,且没有干燥。
C.定容时俯视液面。
D.定容摇匀后,液面下降,又加水至刻度线。
(5)取配制好的溶液50 mL用水稀释到100 mL所得溶液中Cu2+的物质的量浓度为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com