
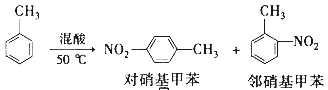
【题目】常见的一硝基甲苯有对硝基甲苯和邻硝基甲苯两种,均可用于合成各种染料,某探究小组利用下列反应和装置制备一硝基甲苯。
实验中可能用到的数据:
密度/g·cm-3 | 沸点/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
实验步骤:①按体积比1∶3配制浓硫酸与浓硝酸混合物40mL;
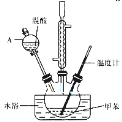
②在三颈瓶中加入15mL(13g)甲苯,按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为50℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯的总质量13.60g。
请回答下列问题:
(1)仪器A的名称是___,使用该仪器前必须进行的操作是___。
(2)若实验后在三颈瓶中收集到的产物较少,可能的原因是___。
(3)分离反应后产物的方案如下:

其中,操作1的名称为____,操作2中需要使用下列仪器中的____(填字母)。
a.冷凝管 b.酒精灯 c.温度计 d.分液漏斗 e.蒸发皿
(4)该实验中一硝基甲苯的产率为___(保留4位有效数字)。
【答案】分液漏斗 检查是否漏液 温度过高,导致HNO3大量挥发 分液 abc 0.7025
【解析】
(1)根据仪器A的特征和形状判断;
(2)根据HNO3易挥发分析解答;
(3)根据流程图,经过操作1,得到了有机混合物和无机混合物分析解答;两种一硝基化合物的沸点不同,可以采用蒸馏的方法分离,据此选择需要的仪器;
(4)根椐方程式,1mol甲苯可以得到1mol对硝基甲苯和邻硝基甲苯的混合物,据此计算理论产量,再根据产率=实际产量÷理论产量计算。
(1)仪器A是分液漏斗,口部和下端颈部存在塞子和活塞,在使用分液漏斗前必须检查是否漏液;故答案为:分液漏斗;检查是否漏液;
(2)若实验后在三颈瓶中收集到的产物较少,可能的原因是温度过高,导致HNO3大量挥发,故答案为:温度过高,导致HNO3大量挥发;
(3)根据流程图,经过操作1,得到了有机混合物和无机混合物,这两种液体不互溶,因此操作1是分液;根据表格数据可知,这两种一硝基甲苯和甲苯的沸点不同,可以采用蒸馏的方法分离一硝基甲苯和甲苯,蒸馏实验中使用到所提供仪器中的酒精灯、温度计、冷凝管,故答案为:分液;abc;
(4)根椐方程式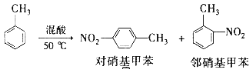 ,1mol甲苯可以得到1mol的一硝基甲苯,理论上13g的甲苯能得到一硝基苯的质量为
,1mol甲苯可以得到1mol的一硝基甲苯,理论上13g的甲苯能得到一硝基苯的质量为![]() =19.36g,所以一硝基苯的产率=
=19.36g,所以一硝基苯的产率=![]() ×100%=0.7025,故答案为:0.7025。
×100%=0.7025,故答案为:0.7025。


科目:高中化学 来源: 题型:
【题目】下列说法一定错误的是( )
A.某些花岗石产生氡(![]() Rn),从而对人体产生伤害,Rn元素的相对原子质量是222
Rn),从而对人体产生伤害,Rn元素的相对原子质量是222
B.Se是人体必需的微量元素,![]() Se和
Se和![]() Se互为同位素,是两种不同的核素
Se互为同位素,是两种不同的核素
C.![]() U的浓缩一直被国际社会关注,其中子数和质子数之差为51
U的浓缩一直被国际社会关注,其中子数和质子数之差为51
D.112号元素属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现取300 mL溶液平均分为3份进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到标准状况下气体1344 mL(假设气体全部逸出);(3)第三份加足量BaCl2溶液后,得干燥沉淀8.24 g,经足量盐酸洗涤、干燥后,沉淀质量2.33 g。根据上述实验,以下推测正确的是()
A.Cl-一定存在B.原溶液CO32-浓度为0.1 mol﹒L-1
C.Ca2+可能存在D.K+一定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于可逆反应:aA(g)+bB(g)![]() cC(g)+dD(g) ΔH的有关图像如下:
cC(g)+dD(g) ΔH的有关图像如下:
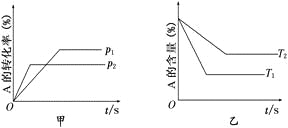
则下列不正确的是
A.p1<p2T1>T2
B.减小压强,正逆反应速率都减小,平衡右移
C.ΔH>0 ΔS>0
D.升高温度,混合气体的平均摩尔质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为![]() ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为____(写出元素符号,下同);
(2)B为____,简化电子排布式是____;
(3)C为____,外围电子排布式是____;
(4)D为____,轨道表示式是____;
(5)E原子结构示意图是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法不正确的是
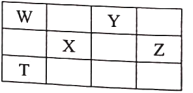
A.原子半径:r(X)>r(Z)>r(W)>r(Y)
B.单质Z2、Y3和Z与Y形成的化合物ZY2均可用于自来水消毒
C.X元素可形成两种或以上的单质,且在一定条件下可以相互转化
D.T元素的单质具有半导体的特性,其最高价氧化物对应水化物是一种强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是

A. 一定含有Al,其质量为4.05g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2 和FeCl2
D. 一定含有(NH4)2SO4 和MgCl2,且物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度为1.25g/L,绿色植物通过光合作用将B和水转化为G和F,其中F是重要的营养物质。E是具有果香味的油状液体,且存在如下转化关系。
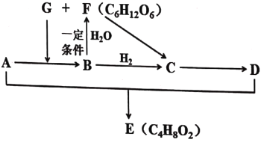
(1)D中官能团的名称是______。A与D的反应类型为______。
(2)写出B与H2在一定条件下生成C的反应方程式______。
(3)下列说法不正确的是______。
A.E和F在酸性下均可水解得到C
B.由A可直接反应生成C,也可直接反应生成D,两个反应类型相同
C.用新制的Cu(OH)2悬浊液能鉴别C、D、E、F四种物质
D.等质量的F、D、E物质完全燃烧,三者消耗![]() 的量相同
的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
A | B | ||||||
D | E | F | |||||
C | G | H |
(1)上述元素的单质中熔点最高的可能是________________(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________________________________________。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为___________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第__________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___________(填字母代号)元素组成的,用化学方程式表示吸收原理_________________________________________________________________。
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com