


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
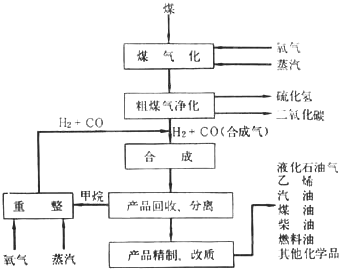
| A、可用图①所示装置收集SO2 |
| B、可用图②所示装置比较KMnO4、Cl2、S的氧化性强弱 |
| C、可用图③所示装置除去CH4中混有的少量C2H4 |
| D、可用图④所示装置防止铁钉生锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:
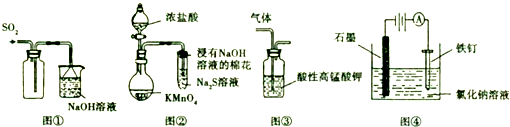
 钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.
钒(V)及其化合物广泛应用于工业催化、新材料和新能源等领域.查看答案和解析>>
科目:高中化学 来源: 题型:
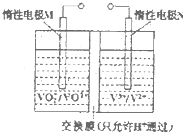
 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.| [NH3?H2O] | ||
[N
|
| 5.56 |
查看答案和解析>>
科目:高中化学 来源: 题型:
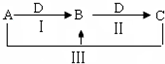 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH皆等于3 的两种溶液都稀释100倍后,pH都为5 |
| B、10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
| C、在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A) |
| D、室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系可能是:c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol NH3溶于足量水中(不考虑氨气挥发),溶液中N原子的数目为0.1NA |
| B、在常温下,若CO与CO2的体积相等,则它们的物质的量相等 |
| C、标准状况下,22.4L NO与CO2的混合气体中含有O的原子数为3NA |
| D、在常温常压下,22.4L氢气的质量为2g |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、有机物X与Y互为同系物 |
| B、有机物Y与阿维A酯均能与NaOH溶液反应 |
| C、一定条件下1mol阿维A酯能与4mol H2发生加成反应 |
| D、X中有6种化学环境不同的氢原子,Y中有1个手性碳原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 2-乙基丙烷 2-乙基丙烷 |
| B、2-甲基丙烯 (CH3)2C=CH2 |
C、1,3,4-三甲苯  |
| D、2,2-二甲基-3-丁醇 (CH3)3C-CHOH-CH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com