
【题目】纯铜呈紫红色,故又称紫铜。而铜的合金有黄铜、青铜和白铜等。其中Cu与Zn的合金称黄铜。黄铜有优良的导热性和耐腐蚀性,可用作各种仪器零件。为了测定某黄铜样品中铜的质量分数,取20克该黄铜样品加入到50克稀硫酸中,恰好完全反应,产生气体0.2克氢气。试求:
(1)该黄铜样品中铜的质量分数_________。
(2)原稀硫酸溶液中溶质质量分数________。
科目:高中化学 来源: 题型:
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是( )
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)>c(K+)-c(CN-)
D. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
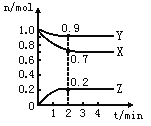
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为V(Z)= __________。
(3)2min反应达平衡,容器内混合气体的平均相对分子质量比起始时______(填增大、减小或不变);混合气体密度比起始时_______(填增大、减小或不变).
(4)将amolx与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
(5)下列措施能加快反应速率的是_________。
A.恒压时充入He;B.恒容时充入He;C.恒容时充入X;D.及时分离出Z;E.升高温度; F.选择高效的催化剂
(6)下列说法正确的是__________。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率加快,正反应速率大于逆反应速率
F.加入高效催化剂可加快正、逆反应速率,化学平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去NaCl溶液中混有的Ca2+、Mg2+、SO42﹣、HCO3﹣等杂质,通常采用以下四种试剂:①Na2CO3 ②BaCl2 ③NaOH ④盐酸,加入试剂顺序合理的是( )
A.④②①③
B.①③②④
C.③②①④
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化学用语是学习化学的重要工具。请按要求用化学用语填空:
①2个铜原子___________。
②5个氢氧根离子______________。
③最理想能源的气体单质_________________。
④氧化铝中铝元素的化合价为+3价________。
⑤可用于人工降雨的干冰______________。
(2)生活处处有化学,请联系学过的化学知识。回答下列问题:
①包饺子的食材有面粉、韭草、瘦肉、植物油、食盐等。其中富含糖类的是_________。
②人体缺____元素能导致儿童发育不良或佝偻病,老年人会导致骨质疏松。
③加了洗涤剂的水能除去衣服上的油污,是利用了洗涤剂的__________作用。
④铁锅容易生锈的主要原因是铁与空气中的________、水蒸气发生了化学反应。
⑤玻璃杯、塑料盆、不锈钢餐具等是生活中常见的日用品,其中属于有机合成材料制成的是____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知石墨在一定条件下转化成金刚石是吸热反应,由此可能出的正确结论是
A.金刚石比石墨更稳定B.石墨比金刚石更稳定
C.石墨转化成金刚石是物理变化D.石墨和金刚石的结构相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(t℃)时,测得0.01 molL-1的NaOH溶液的pH=11,则该温度下水的离子积Kw=________;在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va:Vb=__________;
(2)若所得混合液为中性,且a+b=12,则Va:Vb=__________;
(3)若所得混合液的pH=10,且a=12,b=2,则Va:Vb=__________;
(4)有两瓶pH=2的酸溶液,一瓶为强酸,一瓶为弱酸。现只有石蕊试液、酚酞试液、pH试纸和蒸馏水,而没有其他试剂。简述如何用最简单的方法来确定哪瓶为强酸。所选试剂是__________;采用的方法为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是制备太阳能电池板的主要原料,电池板中还含有硼、氮、钛、钻、钙等多种化学物质。
请回答下列问题:
(1)第二周期元素的电负性按由小到大的顺序排列,B元素排在第__________位。
(2)硅酸根有多种结构形式,一种无限长链状结构如图1所示,其化学式为____________,Si原子的杂化类型为__________________。
(3)N元素位于元素周期表_____________区;基态N原子中,核外电子占据最高能级的电子云有____个伸展方向。
(4)[Co(NH3)6]3+的几何构型为正八面体形,Co在中心。
①[Co(NH3)6]3+中,1个Co提供_______________个空轨道。
②若将[Co(NH3)6]3+中的两个NH3分子换成两个Cl-,可以形成_________种不同的结构形式。
(5)—种由Ca、Ti、O三种元素形成的晶体的立方晶胞结构如图2所示。
①与Ti紧邻的Ca有___________________个。
②若Ca与O之间的最短距离为α pm,阿伏加德罗常数的值为NA,则晶体的密度ρ=__________________g· cm-3(用含α、NA的代数式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究小组,用废弃的黄铜(铜锌合金),通过两种途径制取硫酸铜晶体。实验流程如图所示:

(1)操作a为_____,该操作中用到的玻璃仪器有烧杯、_____、玻璃棒。
(2)浓硫酸是化学实验室里一种常见的酸。
①实验室稀释浓硫酸的操作是:将______________________,并用玻璃棒不断搅拌。
②化学实验应高度关注安全问题。若不慎将少量浓硫酸沾到皮肤上,应先用大量水冲洗,再涂_______________溶液。
(3)如图是实验室用过氧化氢溶液和二氧化锰制取氧气的装置。

①主要实验操作步骤有:
a.收集气体 b.检查装置气密性 c.将二氧化锰放入锥形瓶中 d.从长颈漏斗中注入过氧化氢溶液
正确的操作顺序是_____(写字母序号)。
②在实验过程中,某同学因加入的药品量不足,致使集气瓶内剩余少量水。若想集满这瓶氧气,在不拆卸装置和不添加药品的前提下,请帮他想出种解决的方法__________________。
(4)操作b的顺序为蒸发浓缩、_____ 过滤、干燥。
(5)下列测定稀硫酸pH的操作正确的是_____ (写字母序号)。
A.将pH试纸直接插入稀硫酸中
B.先将pH试纸用蒸馏水润湿
C.用玻璃棒蘸取少量稀硫酸,滴在pH试纸上
D.根据试纸显示的颜色估算出溶液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com