
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
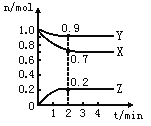
(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为V(Z)= __________。
(3)2min反应达平衡,容器内混合气体的平均相对分子质量比起始时______(填增大、减小或不变);混合气体密度比起始时_______(填增大、减小或不变).
(4)将amolx与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=n(Z),则原混合气体中a:b=__________。
(5)下列措施能加快反应速率的是_________。
A.恒压时充入He;B.恒容时充入He;C.恒容时充入X;D.及时分离出Z;E.升高温度; F.选择高效的催化剂
(6)下列说法正确的是__________。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率加快,正反应速率大于逆反应速率
F.加入高效催化剂可加快正、逆反应速率,化学平衡正向移动
【答案】 3X(g)+Y(g)![]() 2Z(g) 0.05mol/(L·min) 增大 不变 5:3 CEF ACE
2Z(g) 0.05mol/(L·min) 增大 不变 5:3 CEF ACE
【解析】(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式。
(2)根据V(Z)= c(Z)/ t计算反应速率V(Z)。
(3)混合气体的平均相对分子质量M=m/n,混合气体密度ρ=m/V来判断。
(4)根据化学反应中的三行式进行计算。
(5)根据影响化学反应速率的因素分析,升温、增压等均能加快反应速率。
(6)A.反应伴随能量变化,升高温度改变化学反应的限度;B.升高温度正逆反应速率均加快;C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关;D.化学反应的限度与反应物性质和外部因素有关,是可能改变的; E.增大Y的浓度,正反应速率加快,逆反应速率同时加快。
(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且n(X): n(Y): n(Z)=0.3:0.1:0.2=3:1;2,则反应的化学方程式为: 3X(g)+Y(g)![]() 2Z(g);正确答案: 3X(g)+Y(g)
2Z(g);正确答案: 3X(g)+Y(g)![]() 2Z(g)。
2Z(g)。
(2)在2min时间内,用Z表示反应的平均速率V(Z)= c(Z)/ t=0.2/2×2=0.05mol/(L·min) ;正确答案: 0.05mol/(L·min)。
(3)混合气体的平均相对分子质量M=m/n,从开始到平衡,质量是守恒的,但是n是逐渐减小的,所以M会变大,混合气体密度ρ=m/V,从开始到平衡,质量是守恒的,体积是不变的,所以密度始终不变;正确答案:增大;不变。
(4) 3X(g)+ Y(g) ![]() 2Z(g)(设Y的变化量是x)
2Z(g)(设Y的变化量是x)
初始量 a b 0
变化量 3x x 2x
平衡量 a-3x b- x 2x
当n(X)=n(Y)=n(Z), a-3x=b- x=2x,则a=5 x,b=3x,所以原混合气体中a:b=5:3;正确答案:5:3。
(5)A.恒压时充入He,体系分压减小,反应速率减小,故错误;B.恒容时充入He,不影响体系压强和浓度,反应速率不变,故错误;C.恒容时充入X,X的浓度增大,反应速率加快,故正确;D.及时分离出Z,浓度不增加,压强减小,平衡右移,反应速率不加快,故错误;E.升高温度,任何化学反应速率加快,故正确;F.选择高效的催化剂,反应速率加快,故正确;正确答案:CEF。
(6)A.反应伴随能量变化,升高温度改变化学反应的限度,故正确;B.升高温度正逆反应速率均加快,故错误;C.化学反应的限度与反应物性质和外部因素有关,与时间长短无关,故正确; D.化学反应的限度与反应物性质和外部因素有关,是可能改变的,故错误;E.增大Y的浓度,正反应速率加快,逆反应速率同时加快,故正确;F.加入高效催化剂可加快正、逆反应速率,但是加快程度相同,所以化学平衡不发生移动,F错误;正确答案:ACE。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】甲图表示的是pH对植物和人的淀粉酶活性的影响;乙图表示的是3种脱氢酶(A、B、C)的活性受温度影响的情况。下列叙述正确的是( )

A. 从甲图中可以知道pH=6时植物淀粉酶的活性最高
B. 从乙图中无法知道酶C的最适温度
C. 从甲图中可以知道若细胞由酸性变成碱性时,淀粉酶的活性逐渐升高
D. 从乙图中可以知道酶活性温度范围最广的是B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A、B、D、E、F为原子序数依次增大的前四周期元素,其中A的最外层电子数是其内层电子数的2倍,B、D、E为同周期元素,B原子的核外电子总数是其未成对电子数的5倍,E原子最外层有1个未成对电子,F原子核外有22种运动状态的电子。请回答下列问题:
(1)F元素位于周期表___________区,其价电子排布图为:___________。
(2)B、D、E三种元素中,第一电离能最小的是_______________________ (填元素符号);写出AD2的等电子体___________ (分子和阴离子各写一种)。
(3)AO2和DO2熔点高的是___________,原因是___________。
(4)B的单质和E的单质反应可形成原子个数比为1∶3的化合物M,M的立体构型为___________,中心原子的杂化轨道类型为___________。
(5)元素F有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是F晶体的一种晶胞,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为___________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的CH2ClCH2Cl(即1,2-二氯乙烷),可采取的方法是
A.乙烯与Cl2加成
B.乙烯与HCl加成
C.乙烷与Cl2按1∶2的体积比在光照条件下反应
D.乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】米饭遇到碘酒时显蓝色,咀嚼米饭后有甜味,这说明( )
A. 米饭中只含有淀粉 B. 米饭咀嚼后只含单糖
C. 米饭咀嚼时单糖聚合成淀粉 D. 米饭咀嚼时淀粉发生了水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.钠保存在石蜡油或煤油中
B.实验室盛装NaOH溶液的试剂瓶用玻璃塞
C.保存FeSO4溶液需加入少量铁粉
D.氯水保存在棕色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为甲、乙两种物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )

A. 甲物质的溶解度大于乙物质的溶解度
B. 甲中含有少量的乙,可以用蒸发溶剂的方法提纯乙
C. t2℃时,乙饱和溶液中溶质的质量分数一定小于甲饱和溶 液中溶质的质量分数
D. t2℃时,将甲、乙两种物质的溶液分别降温至t1℃,析出晶体的质量甲一定大于乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铜呈紫红色,故又称紫铜。而铜的合金有黄铜、青铜和白铜等。其中Cu与Zn的合金称黄铜。黄铜有优良的导热性和耐腐蚀性,可用作各种仪器零件。为了测定某黄铜样品中铜的质量分数,取20克该黄铜样品加入到50克稀硫酸中,恰好完全反应,产生气体0.2克氢气。试求:
(1)该黄铜样品中铜的质量分数_________。
(2)原稀硫酸溶液中溶质质量分数________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,即属于非氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应B.灼热的炭与CO2反应
C.铝与稀盐酸D.H2与O2的燃烧反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com