
【题目】部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
下列选项正确的是( )
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者
C. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)>c(K+)-c(CN-)
D. 浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(NH4+)的大小顺序为③>②>①
【答案】D
【解析】A. 酸性:HCN>HCO3-,所以CN-+H2O+CO2=HCN+HCO3,故A错误;B. 酸性:HCOOH>HCN,等pH的HCOOH和HCN前者浓度较小,所以中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故B错误;C. 电荷守恒:c(Na+)+c(H+)=c(HCOO-)+c(OH-),c(K+)+c(H+)=c(CN-)+c(OH-),由此可得c(Na+)-c(HCOO-)=c(OH-)-c(H+),c(K+)-c(CN-)=c(OH-)-c(H+),酸性:HCOOH>HCN,所以水解程度:HCOONa,物质的量浓度相等的HCOONa和KCN溶液中,前者c(OH-)较小,c(H+)较大,因此,c(Na+)-c(HCOO-)<c(K+)-c(CN-),故C错误;D. ①![]() 、CO32-水解互促,②
、CO32-水解互促,②![]() 的水解不受其它离子的影响,③
的水解不受其它离子的影响,③![]() 、Fe2+的水解相互抑制,所以浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(N
、Fe2+的水解相互抑制,所以浓度均为0.1 mol·L-1的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2溶液中,c(N![]() )的大小顺序为③>②>①,故D正确。故选D。
)的大小顺序为③>②>①,故D正确。故选D。


科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲图表示的是pH对植物和人的淀粉酶活性的影响;乙图表示的是3种脱氢酶(A、B、C)的活性受温度影响的情况。下列叙述正确的是( )

A. 从甲图中可以知道pH=6时植物淀粉酶的活性最高
B. 从乙图中无法知道酶C的最适温度
C. 从甲图中可以知道若细胞由酸性变成碱性时,淀粉酶的活性逐渐升高
D. 从乙图中可以知道酶活性温度范围最广的是B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊五种元素在元素周期表中的位置如右图所示,其中戊是同周期中原子半径最小的元素。下列有关判断正确的是( )
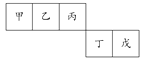
A. 最外层电子数:甲>乙>丙>丁>戊
B. 简单离子的离子半径:戊>丁
C. 含有丁元素的酸有多种
D. 乙的氢化物多种多样,丙、丁、戊的氢化物各有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中物质,能用分液漏斗直接进行分离的是
A. 鸡蛋清溶液中加入饱和硫酸钠溶液
B. 乙酸乙酯和饱和碳酸钠溶液
C. 乙酸和乙醇
D. 甘油和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
A、B、D、E、F为原子序数依次增大的前四周期元素,其中A的最外层电子数是其内层电子数的2倍,B、D、E为同周期元素,B原子的核外电子总数是其未成对电子数的5倍,E原子最外层有1个未成对电子,F原子核外有22种运动状态的电子。请回答下列问题:
(1)F元素位于周期表___________区,其价电子排布图为:___________。
(2)B、D、E三种元素中,第一电离能最小的是_______________________ (填元素符号);写出AD2的等电子体___________ (分子和阴离子各写一种)。
(3)AO2和DO2熔点高的是___________,原因是___________。
(4)B的单质和E的单质反应可形成原子个数比为1∶3的化合物M,M的立体构型为___________,中心原子的杂化轨道类型为___________。
(5)元素F有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是F晶体的一种晶胞,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为___________g·cm-3(用NA表示阿伏加德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲制取较纯净的CH2ClCH2Cl(即1,2-二氯乙烷),可采取的方法是
A.乙烯与Cl2加成
B.乙烯与HCl加成
C.乙烷与Cl2按1∶2的体积比在光照条件下反应
D.乙烯先与HCl加成,再与等物质的量的Cl2在光照下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯铜呈紫红色,故又称紫铜。而铜的合金有黄铜、青铜和白铜等。其中Cu与Zn的合金称黄铜。黄铜有优良的导热性和耐腐蚀性,可用作各种仪器零件。为了测定某黄铜样品中铜的质量分数,取20克该黄铜样品加入到50克稀硫酸中,恰好完全反应,产生气体0.2克氢气。试求:
(1)该黄铜样品中铜的质量分数_________。
(2)原稀硫酸溶液中溶质质量分数________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com