
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知CO(g)+H2O(g) ![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:

试回答下列问题:
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强________(填“增大”、“减 小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向逆反应方向进行的有______(选填字母)
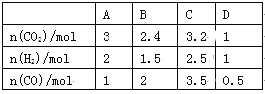
(4)在830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,H2(g)的体积分数是__________。
【答案】
(1)放热
(2)增大 、增大
(3)AC
(4)24%
【解析】
试题分析:(1)根据表中数据可知升高温度平衡常数减小,这说明升高温度平衡向逆反应方向进行,因此上述反应的正反应是放热反应。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,逆反应速率增大。由于反应前后体积不变,则根据PV=nRT可知容器内混合气体的压强增大。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,由于反应前后体积不变,则用物质的量表示浓度计算浓度熵,即此时浓度熵分别是![]() =1.2、
=1.2、![]() =0.9、
=0.9、![]() 、
、![]() =1,所以向逆反应方向进行的有A、C。
=1,所以向逆反应方向进行的有A、C。
(4) CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g)
起始浓度(mol/L) 2 3 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 2-x 3-x x x
则![]()
解得x=1.2
所以H2(g)的体积分数=![]() =24%。
=24%。


科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F、G、H、M九种物质,其中A为淡黄色粉末,G为黄绿色气体单质,E为无色气体单质,F的水溶液与石灰水混合可得D的溶液,它们之间的相互转化关系如图,其他与题无关的生成物均已略去。请回答下列问题:
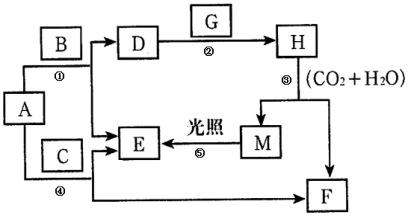
(1)写出H、G的化学式:H ,G 。
(2)写出①、⑤的化学方程式:
① ,⑤ 。
(3)写出③的离子方程式 。
(4)写出F的水溶液与石灰水反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的制备方法正确的是
A.氯化铝溶液和硫化钠溶液反应制备A12S3
B.用镁粉和空气反应制备Mg3N2
C.用铝粉和MnO2制得锰
D.用电解熔融氯化铝的方法制得单质铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室使用的浓盐酸的溶质质量分数为36.5%,密度为1.19 g·cm-3,则物质的量浓度是( )
A.11.9 B.11.9 mol·L-1 C.0.012 mol·L-1 D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年1月《中国科学报》报道,又有 113号、115号、117号和118号四种元素被载入元素周期表。其中118号元素的原子符号为294 118Uuo,“294”是指该原子的
A. 原子序数 B. 电子数 C. 中子数 D. 质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为治理环境,减少雾霾,应采取措施减少二氧化硫、氮氧化物(NOx)和CO2的排放量。
Ⅰ.处理NOx的一种方法是利用甲烷催化还原NOx。
①CH4(g)+4NO2(g)![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ· mol-1
②CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
N2(g)+CO2(g)+2H2O(g) ΔH2=-586.7 kJ· mol-1
(1)若用4.48 L CH4还原NO生成N2,则放出的热量为 kJ(保留两位小数)。(气体体积已折算为标准状况下)
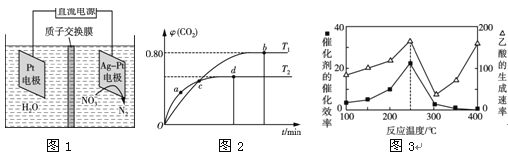
(2)用电化学处理含NO3—的废水,电解的原理如图1所示,则电解时阴极的电极反应式为 ;
Ⅱ.利用I2O5消除CO污染的反应为5CO(g)+I2O5(s)![]() 5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
5CO2(g)+I2(s)。不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入4 mol CO,测得CO2的体积分数(φ)随时间(t)变化曲线如图2所示。
(3)T1时,该反应的化学平衡常数的数值为 。
(4)下列说法不正确的是 (填字母)。
A.容器内气体密度不变,表明反应达到平衡状态
B.两种温度下,c点时体系中混合气体的压强相等
C.d点时,在原容器中充入一定量氦气,CO的转化率不变
D.b点和d点时化学平衡常数的大小关系:Kb<Kd
Ⅲ.以二氧化钛表面覆盖Cu2Al2O4 为催化剂,可以将CO2和CH4通过反应CO2(g)+CH4(g)![]() CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
CH3COOH(g) ΔH<0直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图3所示。
(5)250~300 ℃时,乙酸的生成速率减小的主要原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是
A.Mg2+、Al3+、Cl-、OH-
B.Na+、Ba2+、OH-、SO42—
C.K+、Na+、NO3—、HCO3—
D.K+、NH4+、CO32—、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组依据反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
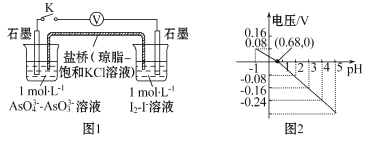
A.调节pH可以改变反应的方向
B.pH=0.68时,反应处于平衡状态
C.pH=5时, 负极电极反应式为2I--2e -= I2
D.pH>0.68时,氧化性I2>AsO43-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com