
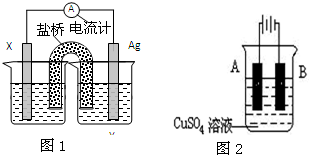
 (Ⅰ)依据氧化还原反应:2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计的原电池如图1所示.
(Ⅰ)依据氧化还原反应:2Ag+(aq)+Fe(s)=Fe2+(aq)+2Ag(s)设计的原电池如图1所示.| 1 |
| 2 |
| 2.56g |
| 64g/mol |


科目:高中化学 来源: 题型:
| A、水 |
| B、NaOH溶液 |
| C、K2CO3溶液 |
| D、NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Li、Na、S |
| B、Na、S、Li |
| C、Na、K、Br |
| D、K、Br、Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
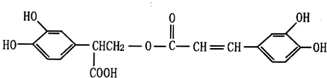
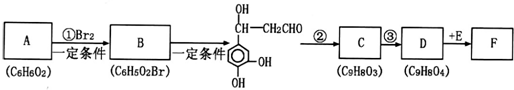
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
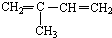 与Br2按物质的量之比1:1发生1,4加成反应方程式
与Br2按物质的量之比1:1发生1,4加成反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com