
| A、还原性:Fe>Cu>FeCl2 |
| B、还原性:Fe>FeCl2>Cu |
| C、氧化性:CuCl2>FeCl3>FeCl2 |
| D、氧化性:FeCl3>FeCl2>CuCl2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
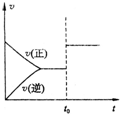 某温度下,将2mol A和3mol B充入一密闭容器中,发生反应aA(g)+B(g)?C(g)+D(g),5min后达到平衡.已知该温度下其平衡常数K=1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )
某温度下,将2mol A和3mol B充入一密闭容器中,发生反应aA(g)+B(g)?C(g)+D(g),5min后达到平衡.已知该温度下其平衡常数K=1,在t0时刻,若保持温度不变将容器体积扩大为原来的10倍,A的转化率不发生变化,则下列说法正确的是( )| A、a=2 |
| B、达平衡时A的转化率为60% |
| C、速率随时间变化关系如右图所示 |
| D、为提高A的转化率,可采取升高温度的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物稳定性最强的是HZ |
| B、原子半径由小到大的顺序为W<M<Y |
| C、室温下,可用Y的容器盛装稀硝酸 |
| D、X的单质可通过电解XZ的水溶液获得 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| C、氧化铜与稀硫酸反应:2H++O2-═H2O |
| D、碳酸氢钠溶液中加入盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
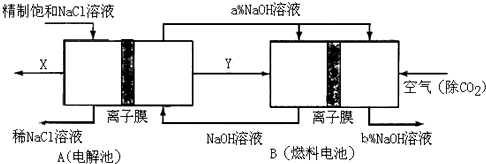
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO+H2O=Ca(OH)2 | ||||
B、C+H2O(g)
| ||||
| C、2F2+2H2O=4HF+O2 | ||||
| D、3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W的最高价氧化物能与水反应生成相应的酸 |
| B、Y、Z元素的单质作电极,在NaOH溶液下构成原电池,Z电极上产生大量气泡 |
| C、室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、98 | B、116 |
| C、158 | D、278 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com