



 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| A、还原性:Fe>Cu>FeCl2 |
| B、还原性:Fe>FeCl2>Cu |
| C、氧化性:CuCl2>FeCl3>FeCl2 |
| D、氧化性:FeCl3>FeCl2>CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe(OH)3 | 1.9 | 3.2 |
| Cu(OH)2 | 4.7 | 6.7 |
| Fe(OH)2 | 6.3 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体, |
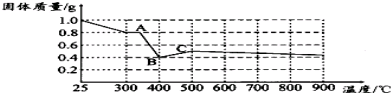
查看答案和解析>>
科目:高中化学 来源: 题型:
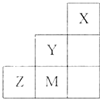
| A、气态氢化物稳定性为:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D、三种元素中,Y的非金属性最强,Y的最高价氧化物的水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团 |
(4)A的核磁共振氢谱如图: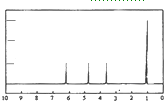 | (4)A中含有 综上所述A的结构简式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯碱工业中,阴极区只需加入水 |
| B、电解熔融氯化铝制取金属铝 |
| C、电镀时,用镀层金属作阳极 |
| D、将钢闸门与外电源正极相连,可防止其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.27×10-5mol/L |
| B、1.45×10-4mol/L |
| C、2.9×10-4mol/L |
| D、5.8×10-4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com