
| A、氯碱工业中,阴极区只需加入水 |
| B、电解熔融氯化铝制取金属铝 |
| C、电镀时,用镀层金属作阳极 |
| D、将钢闸门与外电源正极相连,可防止其腐蚀 |


 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
| A、98 | B、116 |
| C、158 | D、278 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 Na2S溶液中:c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| B、0.1 mol?L-1 pH=8的NH4HCO3溶液中:c(HCO3-)>c(NH4+)>c(OH-)>c(H+) |
| C、浓度均为0.1 mol?L-1的NH3?H2O溶液和NH4Cl溶液等体积混合:c(NH4+)+c(H+)>c(NH3?H2O)+c(OH-) |
| D、0.1 mol?L-1 Na2S溶液与0.1 mol?L-1 NaHS溶液等体积混合:2c(Na+)-3c(S2-)=3c(HS-)+3c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:
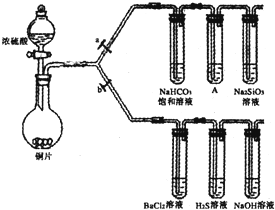
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤、预期现象 | 结论 |
| ①溶液中加入适量四氯化碳 | 假设1正确 |
| ②向溶液中加入 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
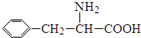 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: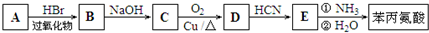
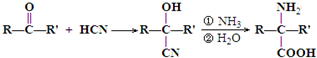
查看答案和解析>>
科目:高中化学 来源: 题型:
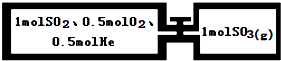
| A、通入气体未反应前,左室压强比右室大 |
| B、第一次平衡时,左室内压强一定小于右室 |
| C、第一次平衡时,SO2的物质的量右室更多 |
| D、第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com