
【题目】碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为________,可能发生副反应有_______。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___________。
(3)向75 mL 4 molL-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。
①写出该反应的离子方程式:___________________________。
②该吸收溶液中离子浓度大小排序为_________________________。
③常温下,a molL-1KHCO3溶液的pH=8,HCO3的水解常数约等于__________。(用含a式表示)。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1= —571.6kJmol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJmol-1
③ CO(g)+2H2(g)![]() CH3OH(g) △H3 = —90.8kJmol-1
CH3OH(g) △H3 = —90.8kJmol-1
计算甲醇蒸气的燃烧热△H=_______________。
(5)某温度下,发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
0 | 5 min | 10 min | 15 min | 20 min | 25 min | |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是________,该温度下,平衡常数=_______。
【答案】2O2-4e=O2↑ C+O2![]() CO2(或2C+O2
CO2(或2C+O2![]() 2CO) CO - 2e+H2O=CO2+2H 2CO2+3OH=CO32+HCO3+H2O c(K)>c(HCO3)>c(CO32)>c(OH)>c(H)
2CO) CO - 2e+H2O=CO2+2H 2CO2+3OH=CO32+HCO3+H2O c(K)>c(HCO3)>c(CO32)>c(OH)>c(H) ![]() -763.8 kJmol-1 增大压强(或缩小体积)、加催化剂 1
-763.8 kJmol-1 增大压强(或缩小体积)、加催化剂 1
【解析】
(1)电解氧化铝得到铝和氧气,阳极上氧离子失去电子发生氧化反应,电极反应式:2O2--4e-=O2↑;生成的氧气在高温下氧化石墨电极,发生的反应有C+O2![]() CO2(或2C+O2
CO2(或2C+O2![]() 2CO)
2CO)
故答案为:2O2--4e-=O2↑;C+O2![]() CO2(或2C+O2
CO2(或2C+O2![]() 2CO)
2CO)
(2)在酸性介质中CO氧化生成CO2,负极反应式为CO-2e-+H2O=CO2+2H+,
故答案为:CO-2e-+H2O=CO2+2H+;
(3)n(KOH)=0.075L×4molL-1=0.3mol,n(CO2)=![]() =0.2mol,因为二者恰好反应,则反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O,
=0.2mol,因为二者恰好反应,则反应的离子方程式为2CO2+3OH-=CO32-+HCO3-+H2O,
故答案为:2CO2+3OH-=CO32-+HCO3-+H2O;
②因为碳酸根水解程度大于碳酸氢根,并且水解后都成碱性,所以离子浓度大小排序为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
③因为amolL-1KHCO3溶液的pH=8,所以c(OH-)=10-6mol/L,HCO3-+H2OH2CO3+OH-,c(OH-)=c(H2CO3)=10-6mol/L,水解程度小,消耗HCO3-可忽省不计,所以K= =
=![]() ;
;
故答案为:![]() ;/span>
;/span>
(4)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJmol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJmol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJmol-1
根据盖斯定律知,①+②×![]() -③得:CH3OH(g)+
-③得:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l)△H=-571.6kJmol-1-566.0kJmol-1×
O2(g)=CO2(g)+2H2O(l)△H=-571.6kJmol-1-566.0kJmol-1×![]() +90.8kJmol-1=-763.8kJmol-1,
+90.8kJmol-1=-763.8kJmol-1,
故答案为:-763.8kJmol-1;
(5)从数据看,I和II达到相同状态,说明平衡没有移动,若该可逆反应是等气体分子数反应,且反应物和产物都是气态,增大压强,平衡不移动,能缩短达到平衡的时间;加入催化剂也能加快反应速率,缩短达到平衡时间;等气体分子数反应,可以用物质的量代替浓度计算平衡常数,达到平衡时,各物质的物质的量都等于0.5mol,所以K=![]() =1,
=1,
故答案为:增大压强(或缩小体积)、加催化剂;1;


科目:高中化学 来源: 题型:
【题目】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
(1) N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)→2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A.N2O分解反应中:分解速率与是否含碘蒸气有关 B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的催化剂
(2)汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO +2NO → N2+2CO2 △H1; 反应II:4CO +2NO2 → N2+4CO2 △H2<0。
针对反应I:①已知:反应N2(g)+O2(g)=2NO(g) △H3=+180.0kJ·mol1,若CO的燃烧热为-283.5kJ·moll 则反应I的△H1=_________kJ·mol1。
②若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是_______。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.2v(N2)正=v(CO)逆
(3)根据原电池原理和电解原理进行如图回答。请回答: 用如图所示装置进行实验(K闭合).
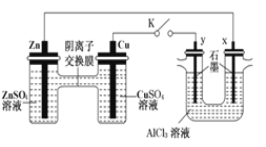
①Zn极为________极;实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动。
②y极的电极反应现象为________;
③写出生活中对钢闸门的一种电化学保护方法________________________。
④有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HClNH4Cl为电解质溶液制取新型燃料电池,请写出该电池的正极反应式______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
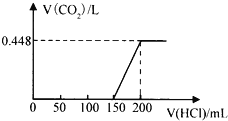
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 56g聚乙烯分子中含碳碳双键的数目为2 NA
B. 2 mol NH3和3molO2在催化剂和加热条件下充分反应生成NO的分子数为2 NA
C. 铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
D. 1L0.5 mol/L Al2Fe(SO4)4溶液中阳离子数目小于1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH![]() 、K+、Mg2+、Cu2+、Al3+、NO
、K+、Mg2+、Cu2+、Al3+、NO![]() 、CO
、CO![]() 、SO
、SO![]() ,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是
,现取三份100 mL溶液进行如下实验:①第一份加足量AgNO3溶液后,有白色沉淀产生。②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。根据上述实验,以下推测不正确的是

A. 原溶液一定不存在H+、Cu2+、CO![]()
B. 不能确定原溶液是否含有K+、NO![]()
C. 原溶液确定含Mg2+、Al3+、NH![]() ,且n(Mg2+) ︰ n(Al3+) ︰ n(NH
,且n(Mg2+) ︰ n(Al3+) ︰ n(NH![]() )=1︰1︰2
)=1︰1︰2
D. 实验所加的NaOH的浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所用试剂、现象和结论均正确的是
选项 | 实验装置 | 现象 | 结论 |
A |
| 装置Ⅲ中有浅黄色沉淀 | 苯和浓溴水发生取代反应 |
B |
| 高锰酸钾溶液褪色,溴的四氯化碳溶液褪色 | 石蜡油的分解产物中含有不饱和烃 |
C |
| 盛有饱和碳酸钠溶液的试管中,上方出现油状液体 | 制备乙酸乙酯 |
D |
| 甲醚有气泡 | 鉴别乙醇与甲醚(CH3OCH3) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为两套实验装置。
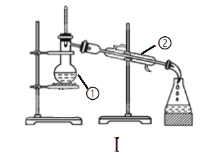
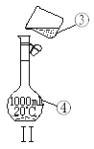
(1)写出下列仪器的名称:
①____;②___ 。
(2)仪器①~④中,使用时必须检查是否漏水的有____。(填序号)
(3)若利用装置I制取蒸馏水,还缺少的仪器是____。
(4)实验室欲使用480mL0.2mol·L-1 CuSO4溶液,配制该溶液包含以下步骤:
A.称取一定质量胆矾(CuSO4·5H2O)放入烧杯,用适量蒸馏水将其完全溶解;
B.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液都转入容量瓶中,并轻轻摇匀;
C.继续向容量瓶中加蒸馏水至凹液面距刻度线1~2cm时,改用胶头滴管滴加,直到溶液的凹液面恰好与刻度线相切为止;
D.把溶液小心地注入容量瓶中;
E.将容量瓶塞好充分摇匀。
请填写下列空白:
①用托盘天平称量胆矾,应该称取的质量是___。
②上述操作的正确顺序是___。
③实验用到的仪器有托盘天平(砝码)、药匙、烧杯、玻璃棒、胶头滴管、___等,玻璃棒的作用是___。
④下列情况中会导致所配溶液浓度偏小的是___(填序号)。
a.容量瓶使用前未干燥
b.转移溶液后,烧杯没有洗涤
c.定容过程观察容量瓶内液面时,俯视刻度线
d.颠倒摇匀后,发现液面低于刻度线,不作任何处置
e.加蒸馏水时不慎超过刻度线,用滴管小心地吸去超出部分,使液面与刻度线相切
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)无机化合物可以根据其组成和性质进行分类:

上图所示的物质分类方法名称是________。
(2)现有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11) ⑦酒精(C2H5OH) ⑧熔融的K2SO4 ⑨纯水。请回答下列问题(用序号):
以上物质中能导电的是________属于电解质的是__________属于非电解质的是______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 常温下,水电离的c(OH-)=1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 常温下,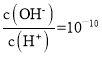 的溶液中:K+、Na+、I-、SO42-
的溶液中:K+、Na+、I-、SO42-
C. 能使酚酞变红的溶液中:Na+、Ba2+、HSO3-、Cl-
D. 0.1 mol·L1 KI溶液:Na+、K+、ClO、OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com