
【题目】下列各组离子在指定的溶液中能大量共存的是
A. 常温下,水电离的c(OH-)=1×10-12mo1·L-1的溶液中:NH4+、Fe2+、SO42-、NO3-
B. 常温下,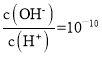 的溶液中:K+、Na+、I-、SO42-
的溶液中:K+、Na+、I-、SO42-
C. 能使酚酞变红的溶液中:Na+、Ba2+、HSO3-、Cl-
D. 0.1 mol·L1 KI溶液:Na+、K+、ClO、OH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】碳及其化合物有广泛应用。
(1)工业冶炼铝,以石墨为阳极。阳极反应式为________,可能发生副反应有_______。
(2)一氧化碳和空气在酸性介质中构成燃料电池,负极反应式为___________。
(3)向75 mL 4 molL-1KOH溶液中缓慢通入4480 mL CO2气体(标准状况)恰好完全被吸收。
①写出该反应的离子方程式:___________________________。
②该吸收溶液中离子浓度大小排序为_________________________。
③常温下,a molL-1KHCO3溶液的pH=8,HCO3的水解常数约等于__________。(用含a式表示)。
(4)已知:① 2H2(g)+O2(g)=2H2O(l) △H1= —571.6kJmol-1
② 2CO(g)+O2(g)=2CO2(g) △H2 = —566.0kJmol-1
③ CO(g)+2H2(g)![]() CH3OH(g) △H3 = —90.8kJmol-1
CH3OH(g) △H3 = —90.8kJmol-1
计算甲醇蒸气的燃烧热△H=_______________。
(5)某温度下,发生可逆反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
CO2(g)+H2(g) △H=-41.0kJ/mol,向某容器中充入1.0 molH2和1.0 mol(g),在一定条件下发生上述反应。混合气体中CO的物质的量与时间关系如下列所示:
0 | 5 min | 10 min | 15 min | 20 min | 25 min | |
I(800℃) | 1.0 | 0.80 | 0.70 | 0.65 | 0.50 | 0.50 |
II(800℃) | 1.0 | 0.7 | 0.60 | 0.50 | 0.50 | 0.50 |
相对实验I,实验II可能改变的条件可能是________,该温度下,平衡常数=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)![]() Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
Z(g) ΔH<0,反应经60 s达到平衡并生成0.3 mol Z,则下列说法中正确的是( )
A. 其他条件不变,升高温度逆反应速率加快,正反应速率减慢
B. 其他条件不变,将容器体积扩大至20 L,则Z的平衡浓度变为原来的![]()
C. 其他条件不变,将容器体积缩小至5 L,平衡正向移动,平衡常数增大
D. 以Y浓度变化表示的反应速率为0.000 5 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数为NA,下列说法正确的是( )
A.1mol钠与足量氧气反应,生成氧化钠和过氧化钠的混合物,转移的电子数为NA
B.通常状况下,NA个CO2分子的体积是22.4L
C.100ml0.1mol/L的H2SO4溶液中H+的个数是0.2NA
D.若1gN2含有m个分子,则NA=m/28
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图(甲)是实验室用氢气还原氧化铜实验的微型快速实验装置.其中的粗铜丝“Ⅰ”可以在试管M中上下移动,实验前先将铜丝“Ⅰ”处理成下端弯曲的一小圆环,并用铁锤击成带小孔的小匙,虚线框中需连入图(乙)(仪器上下端位置固定)的某装置进行实验.图乙中的细铜丝“Ⅱ”一端被弯成螺旋状。
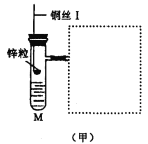
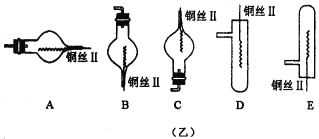
(1)在图甲中,试管M中的液体应选用_________________。
(2)在图示的虚线框中应连入的最合适的装置是___________(填代号)。
(3)上述制氢气的方法与将锌粒直接加入试管中相比,其优点有(写两点):__________________;________________ 。
(4)实验时,细铜丝“Ⅱ”的操作方法是_____________________________________________
(5)若实验室无粗铜丝,而改用无锈粗铁丝,为让其反复使用,则此时M中的液体应该是______________________,可用______________代替锌粒(写化学式), 发生反应的离子方程式为: _________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/L的NaOH溶液450ml。根据这种溶液的配制情况回答下列问题:
(1)在如图所示仪器中,配制上述溶液肯定不需要的是___(填序号),除图中已有仪器外,配制上述溶液还需要到的玻璃仪器是___。
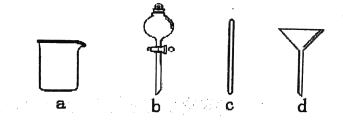
(2)配制时,其正确的操作顺序是(用字母表示,每个操作只用一次)___。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(3)实验两次用到玻璃棒,其作用分别是:先用于___、后用于___。
(4)关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是___
A.①②③④ B.②③ C.①②④ D.②③④
(5)根据计算用托盘天平称取的质量为___g。
II.若配制1mol/L的稀硫酸溶液500mL。
(6)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为:___mL(计算结果保留一位小数)。如果实验室有15mL、20mL、50mL量筒,应选用__mL的量筒最好。
(7)下列操作所造成硫酸浓度偏高的是___。
A.溶解后溶液没有冷却到室温就转移
B.转移时没有洗涤烧杯、玻璃棒
C.向容量瓶加水定容时眼睛俯视刻度线
D.用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶中
E.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向某二元弱酸H2X的钠盐溶液中滴加盐酸,混合溶液中离子浓度与pH的关系如图所示,其中lgX =lgc(X2-)/ c(HX-) 或lgc(HX-)/c(H2X)。下列叙述不正确的是
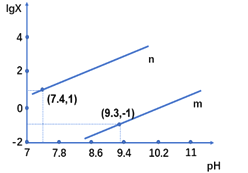
A. 当溶液呈中性时, c(HX-)>c(X2-)>c(H2X)
B. 曲线m表示lgc(X2-)/c(HX-)与pH的变化关系
C. Ka1(H2X)的数量级为10-7
D. 25℃时,NaHX溶液中:c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验事实或数据能说明次氯酸为弱电解质的是
A. 次氯酸具有漂白性 B. 常温时,次氯酸水溶液的pH < 7
C. 次氯酸不稳定,易分解 D. 0.001 molL-1 HClO溶液的pH = 5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象或应用不能用胶体的知识解释的是( )
A.土壤表面积巨大且一般带负电,能吸收NH![]() 等营养离子,使土壤具有保肥能力
等营养离子,使土壤具有保肥能力
B.清晨,人们经常看到的阳光穿过茂密的树木枝叶所产生的美丽景象
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.向FeCl3溶液中加入NaOH溶液,会出现红褐色沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com