
ЁОЬтФПЁПУКШМЩеХХЗХЕФбЬЦјКЌгаSO2КЭNOxЃЌДѓСПХХЗХбЬЦјаЮГЩЫсгъЁЂЮлШОДѓЦјЃЌвђДЫЖдбЬЦјНјааЭбСђЁЂЭбЯѕЃЌЖдЛЗОГБЃЛЄгаживЊвтвхЁЃЛиД№ЯТСаЮЪЬтЃК
Ђё.РћгУCOЭбСђ
(1)ЙЄвЕЩњВњПЩРћгУCOЦјЬхДгШМУКбЬЦјжаЭбСђЃЌдђ25ЁцЪБCOДгШМУКбЬЦјжаЭбСђЕФШШЛЏбЇЗНГЬЪН2CO(g)ЃЋSO2(g)2CO2(g)ЃЋS(s)ЕФьЪБфЁїHЃН_____________ЁЃ25ЁцЃЌ100kPaЪБЃЌгЩдЊЫизюЮШЖЈЕФЕЅжЪЩњГЩ1molДПЛЏКЯЮяЪБЕФЗДгІШШГЦЮЊБъзМФІЖћЩњГЩьЪЃЌвбжЊвЛаЉЮяжЪЕФЁАБъзМФІЖћЩњГЩьЪЁБШчЯТБэЫљЪОЃК
ЮяжЪ | CO(g) | CO2(g) | SO2(g) |
БъзМФІЖћЩњГЩьЪfHm(25Ёц)/kJmol-1 | -110.5 | -393.5 | -296.8 |
(2)дкФЃФтЭбСђЕФЪЕбщжаЃЌЯђЖрИіЯрЭЌЕФЬхЛ§КуЮЊ2LЕФУмБеШнЦїжаЗжБ№ЭЈШы2.2mol COКЭ1mol SO2ЦјЬхЃЌдкВЛЭЌЬѕМўЯТНјааЗДгІЃЌЬхЯЕзмбЙЧПЫцЪБМфЕФБфЛЏШчЭМЫљЪОЁЃ
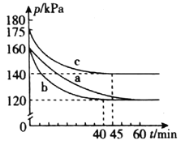
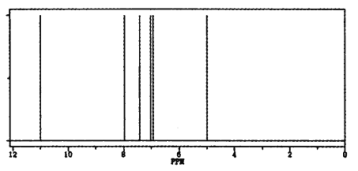
ЂйдкЪЕбщbжаЃЌ40 minДяЕНЦНКтЃЌдђ0ЁЋ40 minгУSO2БэЪОЕФЦНОљЗДгІЫйТЪv(SO2)ЃН_______ЁЃ
ЂкгыЪЕбщaЯрБШЃЌЪЕбщbПЩФмИФБфЕФЬѕМўЮЊ_______________ЃЌЪЕбщcПЩФмИФБфЕФЬѕМўЮЊ_________________ЁЃ
Ђђ.РћгУNH3ЭбЯѕ
(3)дквЛЖЈЬѕМўЯТЃЌгУNH3ЯћГ§NOЮлШОЕФЗДгІдРэЮЊЃК4NH3(g)ЃЋ6NO(g)5N2(g)ЃЋ6H2O(l)ЁїHЃНЃ1807.98kJЁЄmolЃ1ЁЃдкИеадШнЦїжаЃЌNH3гыNOЕФЮяжЪЕФСПжЎБШЗжБ№ЮЊXЁЂYЁЂZ(ЦфжаX<Y<Z)ЃЌдкВЛЭЌЮТЖШЬѕМўЯТЃЌЕУЕНNOЭбГ§ТЪ(МДNOзЊЛЏТЪ)ЧњЯпШчЭМЫљЪОЁЃ
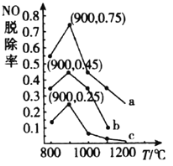
ЂйNH3гыNOЕФЮяжЪЕФСПжЎБШЮЊXЪБЖдгІЕФЧњЯпЮЊ_____________(ЬюЁАaЁБЁАbЁБЛђЁАcЁБ)ЁЃ
ЂкИїЧњЯпжаNOЭбГ§ТЪОљЯШЩ§ИпКѓНЕЕЭЕФдвђЮЊ__________ЁЃ
Ђл900ЁцЬѕМўЯТЃЌЩшZЃН![]() ЃЌГѕЪМбЙЧПp0ЃЌдђ4NH3(g)ЃЋ6NO(g)5N2(g)ЃЋ6H2O(l)ЕФЦНКтГЃЪ§KpЃН_____________(СаГіМЦЫуЪНМДПЩ)ЁЃ
ЃЌГѕЪМбЙЧПp0ЃЌдђ4NH3(g)ЃЋ6NO(g)5N2(g)ЃЋ6H2O(l)ЕФЦНКтГЃЪ§KpЃН_____________(СаГіМЦЫуЪНМДПЩ)ЁЃ
Ђѓ.РћгУNaCIO2ЭбСђЭбЯѕ
(4)РћгУNaClO2ЕФМюадШмвКПЩЮќЪеSO2КЭNO2(ЮяжЪЕФСПжЎБШЮЊ1:1)ЕФЛьКЯЦјЬхЃЌздЩэзЊЛЏЮЊNaClЃЌдђЗДгІЕФРызгЗНГЬЪНЮЊ________________ЁЃ
ЁОД№АИЁП-269.2kJЁЄmol-1 0.01molЁЄL-1ЁЄmin-1 МгШыДпЛЏМС Щ§ИпЮТЖШ c ЮТЖШЕЭгк900ЁцЪБЃЌЗДгІЫйТЪНЯТ§ЃЌЫцзХЮТЖШЩ§ИпЗДгІЫйТЪМгПьЃЌNOЭбГіТЪж№НЅЩ§ИпЃЌЮТЖШИпгк900ЁцЃЌЗДгІДяЕНЦНКтзДЬЌЃЌЗДгІЕФІЄH<0ЃЌМЬајЩ§ИпЮТЖШЃЌЦНКтЯђзѓвЦЖЏЃЌNOЭбГіТЪгжЯТНЕ 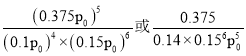 3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O
3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O
ЁОНтЮіЁП
(1)ИљОнЁАБъзМФІЖћЩњГЩьЪЁБЕФЖЈвхПЩЕУЃК
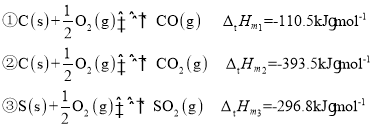
дйИљОнИЧЫЙЖЈТЩ2(ЗДгІЂл-ЗДгІЂй)-ЗДгІЂлПЩЕУЕН2CO(g)ЃЋSO2(g)2CO2(g)ЃЋS(s)ЃЌдђЃЌCOЭбСђЗДгІ2CO(g)ЃЋSO2(g)2CO2(g)ЃЋS(s)ЕФьЪБф![]() ЃЌЙЪД№АИЮЊЃК-269.2kJЁЄmol-1ЃЛ
ЃЌЙЪД№АИЮЊЃК-269.2kJЁЄmol-1ЃЛ
(2)ЂйНсКЯЬтИЩаХЯЂЃЌСаШ§ЖЮЪНгаЃК
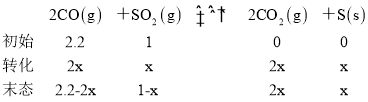
дђ![]() ЃЌНтЕУx=0.8ЃЌдђ
ЃЌНтЕУx=0.8ЃЌдђ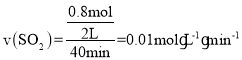 ЃЌЙЪД№АИЮЊ0.010.01molЁЄL-1ЁЄmin-1ЃЛ
ЃЌЙЪД№АИЮЊ0.010.01molЁЄL-1ЁЄmin-1ЃЛ
ЂкгыЪЕбщaЯрБШЃЌЪЕбщbДяЕНЕФЦНКтзДЬЌВЛБфЧвЫљашЪБМфЫѕЖЬЃЌИФБфЕФЬѕМўгІЮЊМгШыСЫДпЛЏМСЃЌгыЪЕбщaЯрБШЃЌЪЕбщcДяЕНЦНКтзДЬЌИФБфЧвЫљашЪБМфЫѕЖЬЃЌПЩФмЪЧдіДѓбЙЧПЛђЩ§ИпЮТЖШЃЌСЊЯЕЗДгІЬиЕуЃЌШєЪЧдіДѓбЙЧПЃЌЦНКтЯђгввЦЖЏЃЌЯђгвЗДгІЕФГЬЖШгІдіДѓЃЌгыЭМЯёВЛЗћЃЌШєЪЧЩ§ИпЮТЖШЃЌЦНКтЯђзѓвЦЖЏЃЌгыЭМЯёЯрЗћЃЌЙЪД№АИЮЊЃКМгШыДпЛЏМСЃЛЩ§ИпЮТЖШЃЛ
(3)ЂйNH3КЭNOЕФЮяжЪЕФСПжЎБШдНДѓЃЌNOЕФЭбГіТЪдТАЁЃЌдђЯрЭЌЮТЖШЯТЃЌВЛЭЌNH3ЁЂNOЮяжЪЕФСПжЎБШЖдгІNOЕФЭбГіТЪЃКX<Y<ZЃЌдђXЖдгІЧњЯпcЃЌYЖдгІЧњЯпbЃЌZЖдгІЧњЯпaЃЌЙЪД№АИЮЊЃКcЃЛ
ЂкNOЕФЭбГіТЪЛсЪмЕНЫйТЪЁЂЦНКтвЦЖЏЕШвђЫиЕФгАЯьЃЌЮТЖШЕЭгк900ЁцЪБЃЌЗДгІЫйТЪНЯТ§ЃЌЫцзХЮТЖШЩ§ИпЗДгІЫйТЪМгПьЃЌNOЭбГіТЪж№НЅЩ§ИпЃЌЮТЖШИпгк900ЁцЃЌЗДгІДяЕНЦНКтзДЬЌЃЌЗДгІЕФІЄH<0ЃЌМЬајЩ§ИпЮТЖШЃЌЦНКтЯђзѓвЦЖЏЃЌNOЭбГіТЪгжЯТНЕЃЌЙЪД№АИЮЊЃКЮТЖШЕЭгк900ЁцЪБЃЌЗДгІЫйТЪНЯТ§ЃЌЫцзХЮТЖШЩ§ИпЗДгІЫйТЪМгПьЃЌNOЭбГіТЪж№НЅЩ§ИпЃЌЮТЖШИпгк900ЁцЃЌЗДгІДяЕНЦНКтзДЬЌЃЌЗДгІЕФІЄH<0ЃЌМЬајЩ§ИпЮТЖШЃЌЦНКтЯђзѓвЦЖЏЃЌNOЭбГіТЪгжЯТНЕЃЛ
ЂлбЙЧПЮЊp0ЃЌИљОнЧњЯпaЩЯNH3гыNOЕФЮяжЪЕФСПжЎБШЮЊ![]() ЃЌдђNH3ЕФЗжбЙЮЊ0.4p0ЃЌNOЕФЗжбЙЮЊ0.6p0ЃЌСаШ§ЖЮЪНгаЃК
ЃЌдђNH3ЕФЗжбЙЮЊ0.4p0ЃЌNOЕФЗжбЙЮЊ0.6p0ЃЌСаШ§ЖЮЪНгаЃК
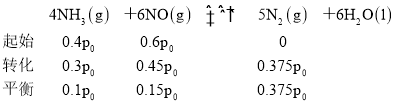
дђЗДгІЕФЦНКтГЃЪ§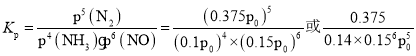 ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК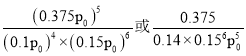 ЃЛ
ЃЛ
(4)дкМюадЛЗОГЯТЃЌClO2-бѕЛЏЕШЮяжЪЕФСПЕФSO2КЭNO2ЃЌClO2-БфЮЊCl-ЃЌSO2БфЮЊSO42-ЃЌNO2БфЮЊNO3-ЃЌРћгУбѕЛЏЛЙдЗДгІЙцТЩНјааХфЦНЃЌПЩЕУРызгЗДгІЗНГЬЪН3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2OЃЌЙЪД№АИЮЊЃК3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2OЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПе§ЖЁУбПЩзїаэЖргаЛњЮяЕФШмМСМАнЭШЁМС ЃЌГЃгУгкЕчзгМЖЧхЯДМСМАгУгкгаЛњКЯГЩ ЁЃЪЕбщЪвгУе§ЖЁДМгыХЈH2SO4ЗДгІжЦШЁЃЌЪЕбщзАжУШчгвЭМЃЌМгШШгыМаГжзАжУТдШЅЁЃЗДгІдРэгыгаЙиЪ§ОнЃК
ЗДгІдРэЃК 2C4H9OH ![]() C4H9OC4H9+H2O
C4H9OC4H9+H2O
ИБЗДгІЃКC4H9OH![]() C2H5CH=CH2+H2O
C2H5CH=CH2+H2O
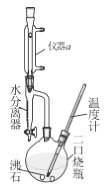
ЮяжЪ | ЯрЖдЗжзгжЪСП | ШлЕу/Ёц | ЗаЕу/Ёц | ШмНтад | ||
ЫЎ | 50%СђЫс | ЦфЫќ | ||||
е§ЖЁДМ | 74 | -89.8 | 117.7 | ЮЂШм | взШм | ЖўепЛЅШм |
е§ЖЁУб | 130 | -98 | 142.4 | ВЛШм | ЮЂШм | |
ЪЕбщВНжшШчЯТЃК
ЂйдкЖўПкЩеЦПжаМгШы0.34molе§ЖЁДМКЭ4.5mLХЈH2SO4,дйМгСНаЁСЃЗаЪЏЃЌвЁдШЁЃ
ЂкМгШШНСАшЃЌЮТЖШЩЯЩ§жС100~ll0ЁцПЊЪМЗДгІЁЃЫцзХЗДгІЕФНјааЃЌЗДгІжаВњЩњЕФЫЎОРфФ§КѓЪеМЏдкЫЎЗжРыЦїЕФЯТВуЃЌЩЯВугаЛњЮяжСЫЎЗжРыЦїжЇЙмЪБЃЌМДПЩЗЕЛиЩеЦПЁЃМгШШжСЗДгІЭъГЩЁЃ
ЂлНЋЗДгІвКРфШДЃЌвРДЮгУЫЎЁЂ50%СђЫсЯДЕгЁЂЫЎЯДЕгЃЌдйгУЮоЫЎТШЛЏИЦИЩдяЃЌЙ§ТЫЃЌеєСѓЃЌЕУе§ЖЁУбЕФжЪСПЮЊWgЁЃ
ЧыЛиД№ЃК
ЃЈ1ЃЉжЦБИе§ЖЁУбЕФЗДгІРраЭЪЧ____________ЃЌвЧЦїaЕФУћГЦЪЧ_________ЁЃ
ЃЈ2ЃЉВНжшЂйжавЉЦЗЕФЬэМгЫГађЪЧЃЌЯШМг______ЃЈЬюЁАе§ЖЁДМЁБЛђЁАХЈH2SO4ЁБЃЉЃЌЗаЪЏЕФзїгУЪЧ___________________ЁЃ
ЃЈ3ЃЉВНжшЂкжаЮЊМѕЩйИБЗДгІЃЌМгШШЮТЖШгІВЛГЌЙ§_________ЁцЮЊвЫЁЃЪЙгУЫЎЗжРыЦїВЛЖЯЗжРыГіЫЎЕФФПЕФЪЧ________ЁЃШчКЮХаЖЯЗДгІвбОЭъГЩЃПЕБ_____ЪБЃЌБэУїЗДгІЭъГЩЃЌМДПЩЭЃжЙЪЕбщЁЃ
ЃЈ4ЃЉВНжшЂлжагУ50%СђЫсЯДЕгЕФФПЕФЪЧЮЊСЫГ§ШЅ______________ЁЃБОЪЕбщжаЃЌе§ЖЁУбЕФВњТЪЮЊ_____ЃЈСаГіКЌWЕФБэДяЪНМДПЩЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЁзщРћгУШчЭМЫљЪОзАжУБШНЯХЈЁЂЯЁЯѕЫсбѕЛЏадЕФЧПШѕЁЃ

ЪЕбщВНжшШчЯТЃК
Ђё.СЌНгКУзАжУЃЌВЂМьВщзАжУЕФЦјУмадЃЛ
Ђђ.МгШыЯргІЪдМСЃЌЙиБеЕЏЛЩМаЃЌДђПЊЪдЙмЂйЃЌЯђЦфжаМгШыЪЪСПЕФ![]() ЗлФЉЃЌСЂМДИЧЩЯЯ№ЦЄШћЃЛ
ЗлФЉЃЌСЂМДИЧЩЯЯ№ЦЄШћЃЛ
Ђѓ.НЋЭЫПЩьШыХЈЯѕЫсжаЃЌЙлВьЯжЯѓЃЛ
Ђє.НЋЭЫПЬсЦ№ЃЌДђПЊЕЏЛЩМаЃЌдйЯђзАжУЂйжаЭЈШывЛЖЈСПЕФCO2ЦјЬхЁЁ
ЛиД№ЯТСаЮЪЬтЃК
(1)МьВщИУзАжУЦјУмадЕФЗНЗЈЮЊ____________________________________________________________ЁЃ
(2)МгШыЩйСП![]() ЗлФЉЕФзїгУЮЊ________________________ЃЛЭЈШывЛЖЈСПЕФCO2ЦјЬхЕФзїгУЮЊ________________________ЁЃ
ЗлФЉЕФзїгУЮЊ________________________ЃЛЭЈШывЛЖЈСПЕФCO2ЦјЬхЕФзїгУЮЊ________________________ЁЃ
(3)НЋЭЫПЩьШыХЈЯѕЫсжаЃЌСЂМДЙлВьЕНЪдЙмЂйжагаКьзиЩЋЦјЬхЩњГЩЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________________________ЃЛКьзиЩЋЦјЬхНјШыЪдЙмЂкжаКѓБфГЩЮоЩЋЃЌЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______________________________ЃЌЪдЙмЂлвКУцЩЯЗНЮоКьзиЩЋЦјЬхГіЯжЃЌЪдЙмЂмвКУцЩЯЗНВњЩњКьзиЩЋЦјЬхЭЌЪБШмвКГіЯжЛЦЩЋЃЌдђЪдЙмЂмжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ______________________________ЃЌЫЕУїХЈЯѕЫсЕФбѕЛЏадЧПгкЯЁЯѕЫсЁЃ
(4)NO2гыЧтбѕЛЏФЦШмвКЗДгІЩњГЩСНжжбЮЃЌЦфРызгЗНГЬЪНЮЊ______________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГЛЏбЇаЫШЄаЁзщгУШчЭМЫљЪОзАжУНјааЕчЛЏбЇдРэЕФЪЕбщЬНОПЃЌеД№ЯТСаЮЪЬтЃК
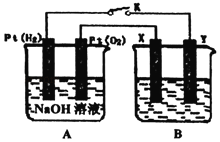
(1)ЭЈШыO2ЕФPtЕчМЋЮЊЕчГиЕФ_____ЃЈЬюЁАе§МЋЁБЛђЁАИКМЋЁБЃЉЃЌЕчМЋЗДгІЪНЮЊ_____ЁЃ
(2)ШєBЕчГиЮЊЕчЖЦГиЃЌФПЕФЪЧдкФГЖЦМўЩЯЖЦвЛВувјЃЌдђXЕчМЋВФСЯЮЊ_____ЃЈЬюЁАЖЦМўЁБЛђЁАвјЁБЃЉЁЃ
(3)ШєBЕчГиЕФЕчНтжЪШмвКЮЊ500mL1.0molLЉ1ЕФNaClШмвКЃЈЕЮгаЩйСПзЯЩЋЪЏШяЪдвКЃЉЃЌXЁЂYНдЮЊЖшадЕчМЋЃЌЕчГиЙЄзїЙ§ГЬжаЗЂЯжXМЋШмвКЯШБфКьКѓОжВПЭЪЩЋЃЌНтЪЭдвђ_____ЁЃЕБЕчГиЙЄзївЛЖЮЪБМфКѓЖЯПЊKЃЌYМЋЙВЪеМЏЕН560mLЦјЬхЃЈБъзМзДПіЃЉЃЌДЫЪБBГижаШмвКЕФpHЃН_____ЃЈМйЩшШмвКЬхЛ§ВЛБфЃЉЃЌзЊвЦЕчзгЕФЪ§ФПЮЊ_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвЛЖЈЬѕМўЯТЃЌгћЪЕЯжЯТСагаЛњЮяжЎМфЕФзЊЛЏЃЌЫљбЁЪдМСе§ШЗЕФЪЧ( )
бЁЯю | ЮяжЪзЊЛЏ | ЪдМС |
A |
| зуСПЫсад |
B |
|
|
C |
| ХЈСђЫсКЭХЈЯѕЫсЕФЛьКЯШмвК |
D |
| фхЕФЫФТШЛЏЬМШмвК |
A.AB.BC.CD.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгаЛњЮяXОпгаЯћбзЙІаЇЃЌЮЊВтЖЈЦфНсЙЙЃЌФГЛЏбЇаЁзщЩшМЦШчЯТЪЕбщЬНОПЙ§ГЬЃК
I. ШЗЖЈXЕФЗжзгЪН
(1)ШЗЖЈXЕФЪЕбщЪНЁЃНЋгаЛњЮяXЕФбљЦЗГфЗжШМЩеЃЌЖдШМЩеКѓЕФЮяжЪНјааЖЈСПВтСПЃЌЫљашзАжУМАЪдМСШчЯТЫљЪОЃК
A.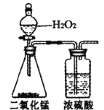 B.
B. C.
C. D.
D.
ЂйзАжУЕФСЌНгЫГађЪЧ________ЁЃ(ЬюзжФИЃЌВПЗжзАжУПЩжиИДЪЙгУ)
ЂкШЁXбљЦЗ6.9gЃЌгУСЌНгКУЕФзАжУНјааЪЕбщЃЌXбљЦЗГфЗжШМЩеКѓЃЌВтЕУBЙмдіжи15.4gЃЌCЙмдіжи2.7gЃЌдђXЕФЪЕбщЪНЮЊ________ЁЃ
(2)ШЗЖЈXЕФЗжзгЪНЁЃXЕФжЪЦзЭМжаЗжзгРызгЗхЖдгІЕФжЪКЩБШзюДѓЮЊ138ЃЌдђXЕФЗжзгЪНЮЊ________ЁЃ
Ђђ. ШЗЖЈЕФНсЙЙ
(3)ШЗЖЈXЕФЙйФмЭХЁЃКьЭтЙтЦзЭМГЪЯжЃЌXжагаOЃHЁЂCЃOЁЂCЃCЁЂБНЛЗЩЯЕФCЃHЁЂєШЫсЩЯЕФC=OЕШЛЏбЇМќвдМАСкЖўШЁДњЬиеїеёЖЏЮќЪеЗхЃЌгЩДЫдЄВтXКЌгаЕФЙйФмЭХга________(ЬюУћГЦ)ЁЃ
(4)ШЗЖЈXЕФНсЙЙЪНЁЃКЫДХеёЖЏЧтЦзШчЯТЭМЫљЪОЃЌXЕФНсЙЙМђЪНЮЊ________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПввЫсввѕЅЪЧвЛжжживЊЕФЛЏЙЄдСЯЃЌЙуЗКгУгквЉЮяШОСЯЁЂЯуСЯЕШЙЄвЕЁЃВщдФзЪСЯЕУЕНЯТСаЪ§ОнЃК
ЮяжЪ | ЗаЕу/Ёц | УмЖШ/ | ЯрЖдЗжзгжЪСП | ЫЎШмад |
ввДМ | 78.0 | 0.8 | 46 | ЛЅШм |
ввЫс | 118.0 | 1.1 | 60 | ПЩШм |
ввЫсввѕЅ | 77.5 | 0.9 | 88 | ЮЂШм |
ввУб | 34.6Ёц | 0.7 | 74 | ЮЂШм |
ХЈСђЫс(98%) | 338.0 | 1.8 | 98 | взШм |
ЮоЫЎТШЛЏИЦ | ПЩгыввДМаЮГЩФбШмгкЫЎЕФCaCl2ЁЄ6C2H5OH | |||
ЧыЛиД№вдЯТЮЪЬтЃК
(1)ЪЕбщЪвГЃгУЯТЭМзАжУРДжЦБИввЫсввѕЅЁЃ
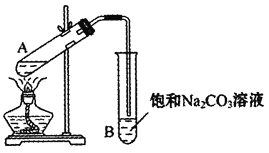
ЂйХфжЦЗДгІЛьКЯвКЪБЃЌввДМЁЂБљДзЫсКЭХЈСђЫсЕФЛьКЯЫГађЪЧ________ЃЛХЈСђЫсЖдЗДгІгаДпЛЏзїгУЃЌЕЋМгШыЕФХЈСђЫсВЛФмЬЋЖрвВВЛФмЬЋЩйЃЌдвђЪЧ________ЁЃ
ЂкЗРжЙМгШШЪБвКЬхБЉЗаЃЌашвЊдкЪдЙмМгШыЫщДЩЦЌЃЌШчЙћМгШШвЛЖЮЪБМфКѓЗЂЯжЭќМЧСЫМгЫщДЩЦЌЃЌгІИУВЩШЁЕФе§ШЗВйзїЪЧ________ЁЃ
AЃЎСЂМДВЙМг BЃЎРфШДКѓВЙМг CЃЎВЛашВЙМг DЃЎжиаТХфСЯ
ЂлЪЕбщжаБЅКЭЬМЫсФЦШмвКЕФзїгУЪЧ________ЁЃ
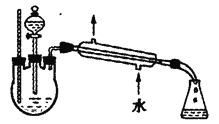
(2)ВњЦЗДПЛЏЁЃЗжвКЗЈДгЪдЙмBжаЗжРыГіЕФввЫсввѕЅжаГЃКЌгавЛЖЈСПЕФввДМЁЂввУбКЭЫЎЃЌЪзЯШЯђввЫсввѕЅжаМгШыЮоЫЎТШЛЏИЦЃЌГ§ШЅ________(ЬюУћГЦ)ЃЛШЛКѓдйМгШыЮоЫЎСђЫсФЦГ§ШЅЫЎЃЌзюКѓНјаа________(ЬюВйзїУћГЦ)ЃЌЕУЕННЯДПОЛЕФввЫсввѕЅЁЃ
(3)ИУЪЕбщжагУ30 gввЫсгы46 gввДМЗДгІЃЌШчЙћЪЕМЪЕУЕНЕФввЫсввѕЅЕФжЪСПЪЧ30.8 gЃЌдђИУЪЕбщжаввЫсввѕЅЕФВњТЪЪЧ________ЁЃ(ВњТЪжИЕФЪЧФГжжЩњГЩЮяЕФЪЕМЪВњСПгыРэТлВњСПЕФБШжЕ)
(4)СэвЛЛЏбЇаЁзщЩшМЦЯТЭМЫљЪОЕФзАжУжЦШЁввЫсввѕЅ(ЬњМмЬЈЁЂЬњМаЁЂМгШШзАжУОљвбТдШЅ)ЁЃДЫзАжУКЭЩЯЭМзАжУЯрБШЕФгХЕуЪЧ________(аДГівЛЬѕМДПЩ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌЯђ![]() бЮЫсжаЕЮМг
бЮЫсжаЕЮМг![]() ШмвКЃЌШмвКЕФ
ШмвКЃЌШмвКЕФ![]() Ыц
Ыц![]() ШмвКЬхЛ§ЕФБфЛЏШчЭМЁЃвбжЊ
ШмвКЬхЛ§ЕФБфЛЏШчЭМЁЃвбжЊ![]() ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
ЯТСаЫЕЗЈВЛе§ШЗЕФЪЧЃЈ ЃЉ
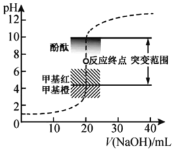
A.![]() гыбЮЫсЧЁКУЭъШЋЗДгІЪБЃЌШмвК
гыбЮЫсЧЁКУЭъШЋЗДгІЪБЃЌШмвК![]()
B.![]() ЪБЃЌШмвК
ЪБЃЌШмвК![]()
C.![]() БъзМШмвКХЈЖШЕФзМШЗаджБНггАЯьЗжЮіНсЙћЕФПЩППадЃЌвђДЫашгУСкБНЖўМзЫсЧтМиБъЖЈ
БъзМШмвКХЈЖШЕФзМШЗаджБНггАЯьЗжЮіНсЙћЕФПЩППадЃЌвђДЫашгУСкБНЖўМзЫсЧтМиБъЖЈ![]() ШмвКЕФХЈЖШЃЌБъЖЈЪБПЩВЩгУМзЛљГШЮЊжИЪОМС
ШмвКЕФХЈЖШЃЌБъЖЈЪБПЩВЩгУМзЛљГШЮЊжИЪОМС
D.бЁдёМзЛљКьжИЪОЗДгІжеЕуЃЌЮѓВюБШМзЛљГШЕФаЁ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПбаОПБэУїЦјПзЕФеХПЊгыБЃЮРЯИАћФЄЩЯЕФH+ЁЊATPaseгазХЗЧГЃУмЧаЕФЙиЯЕЁЃH+ЁЊATPaseБЛРЖЙтгеЕММЄЛюКѓОЭЛсРћгУATPЫЎНтЪЭЗХЕФФмСПНЋH+ЗжУкЕНЯИАћЭтЃЌДЫЪБФкЯђK+РызгЭЈЕРПЊЦєЃЌЯИАћЭтЕФK+зЊвЦНјБЃЮРЯИАћЃЛЭЌЪБЦфЫћЯрЙивѕРызгдкH+ажњЯТвВНјШыБЃЮРЯИАћЃЌДгЖјЪЙЦјПзеХПЊЁЃЦјПзеХПЊдЫЖЏЕФЯрЙиЛњРэШчЯТЭМЫљЪОЁЃ
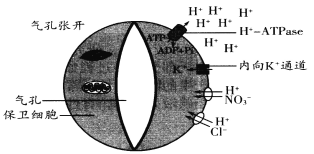
зЂЃКЭМжаСНИіЯИАћЬљНќЦјПзВПЗжЯИАћБкНЯКёЃЌЩьЫѕадНЯаЁЃЌЭтВрНЯБЁ
ЃЈ1ЃЉБЃЮРЯИАћФЄЩЯЕФH+ЁЊATPaseБЛМЄЛюЪБЃЌЯИАћФкЕФH+ЭЈЙ§____________ЕФЗНЪНзЊвЦГіБЃЮРЯИАћЃЛОнЯИАћЮќЫЎгыЪЇЫЎЕФдРэЭЦВтЃЌРЖЙтгеЕМКѓЦјПзеХПЊЕФдвђЪЧ__________________ЁЃ
ЃЈ2ЃЉжВЮягаЪБЮЊЗРжЙЫЎЗжЙ§ЖШЩЂЪЇЦјПзЛсЙиБеЃЌДЫЪБвЖШтЯИАћШдПЩНјааЙтКЯзїгУЃЌЯћКФЕФCO2ПЩРДзд___________КЭ___________ЃЌЕЋЙтКЯЫйТЪЛсУїЯдМѕТ§ЃЛЦјПзПЊЦєЫВМфжВЮявЖШтЯИАћЯћКФC5ЕФЫйТЪЛс___________ЃЈЬюЁАдіДѓЁБЛђЁАМѕаЁЁБЛђЁАВЛБфЁБЃЉЁЃ
ЃЈ3ЃЉПЦбаШЫдБРћгУзЊЛљвђММЪѕдкФтФЯНцБЃЮРЯИАћжаБэДяСЫгЩЙтПижЦЕФK+ЭЈЕРЕААзBLЃЌЪдЭМЬсИпЦјПзЖЏСІЃЌМДЙтеедіЧПЪБЦјПзДђПЊЕФИќПьЃЌЙтееМѕШѕЪБЙиБеЕФвВИќПьЁЃ
ЂйгћЬНОПBLЕААзЪЧЗёЗЂЛгСЫДЫЙІФмЃЌПЩдкБфЛЏЕФЙтееЧПЖШКЭКуЖЈЙтееЧПЖШЯТЃЌЗжБ№Вте§ГЃжВжъКЭзЊЛљвђжВжъЕФЦјПзЖЏСІЃЌИУЪЕбщЕФздБфСПЪЧ_____________________ЁЃ
ЂкШєЪЕбщБэУїBLЕААзЗЂЛгСЫдЄЦкЕФзїгУЃЌЖјдкКуЖЈЙтееЧПЖШЯТЩњГЄЕФзЊЛљвђжъЯЕЩњЮяСПЛ§РлКЭгУЫЎаЇТЪЗНУцЃЌгые§ГЃжВжъЮоУїЯдВювьЃЌЫЕУї____________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com