
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
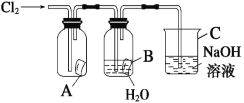
(1)通Cl2一段时间后,A中观察到的现象是_______________,B中观察到的现象是_______________,写出有关反应的化学方程式:_____________________________。
(2)C装置的作用是_____________________________,理由是_______________,写出有关反应的化学方程式:_______________。
【答案】干燥的红色纸条不褪色 湿润的红色纸条褪色 Cl2+H2OHCl+HClO 吸收多余的氯气 氯气有毒,防止污染环境 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
(1)A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,氯气不能使A中干燥纸条褪色,而B中生成HClO,纸条褪色;
(2)氯气有毒,不能排放在空气中,利用NaOH溶液吸收。
(1)A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,氯气无漂白性,不能使A中纸条褪色,而B中氯气与水反应生成HClO和HCl,HClO具有漂白性,所以纸条褪色,氯气与水反应的化学方程式为Cl2+H2OHCl+HClO;
故答案为:干燥的红色纸条不褪色;湿润的红色纸条褪色;Cl2+H2OHCl+HClO;
(2)氯气有毒,不能排放到空气中,Cl2能与NaOH溶液反应生成氯化钠、次氯酸钠和水,则可用NaOH溶液吸收氯气,所以C的作用为吸收多余的Cl2,防止污染环境,发生反应化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:吸收多余的氯气;氯气有毒,防止污染环境;Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:___________;磷原子核外有_____种能量不同的电子。
(2)上述反应的反应物和生成物中含有非极性键的分子是______。(写出物质的化学式)
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列___________________。
(4)NH3的稳定性比PH3的(填“强”或“弱”)_________,判断理由是____________。
(5)A、配平上述反应,并标出电子转移方向与数目_________
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1mol氧化产物,转移电子的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
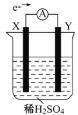
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
 .
.
A. 外电路的电流方向为:X→导线→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:

(1)类比CO2的性质,学习SO2的性质,写出下列反应的离子方程式。
①少量的SO2通入澄清石灰水中:__________________。
②SO2通入Na2SO3溶液中: ________________________。
(2)Y的分子式:___________________。
(3)Z的稀溶液与铁反应的离子方程式为______________________。
(4)检验CO2是否混有SO2,可以使混合气体通过盛有品红溶液的洗气瓶,这是利用了SO2的_____________性,也可以使混合气体通过盛有酸性高锰酸钾稀溶液的洗气瓶,这是利用了SO2的_____________性。
(5)大苏打(Na2S2O3)在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。现欲在实验室制备大苏打,从氧化还原角度分析,合理的是__________(填字母选项)
A.Na2S+S B.Na2SO3+S C.Na2SO3+ Na2SO4 D.SO2+Na2SO4
(6)将X与SO2的水溶液混合后产生淡黄色沉淀,该反应的氧化产物与还原产物的质量之比为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室以铜和浓硫酸为原料,采用两种方法制取胆矾。制备方法如下:
方法一:将铜屑放入浓硫酸中加热
(1)写出该反应的化学方程式______________。
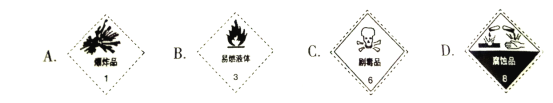
(2)浓硫酸试剂瓶上贴的标签应该是______________(填字母选项)。
(3)通过上述反应后,经过一系列操作,若最终得到胆矾晶体25.0g,则被还原的H2SO4的物质的量为____________mol。
方法二:将铜屑置入稀硫酸中,加热并不断鼓入空气,该反应的化学方程式为:2Cu+ H2SO4+O2![]() 2 CuSO4+2H2O
2 CuSO4+2H2O
(4)写出该反应的离子方程式:____________________________。
(5)上述反应中氧化剂和还原剂的物质的量之比为___________。
(6)充分反应后,将制得的硫酸铜溶液经过蒸发浓缩、___________,过滤,即可得到胆矾晶体。
(7)对比两种方法,方法二相对于方法一有两个明显的优点:
①制取等质量的胆矾消耗的硫酸的量少;
②__________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
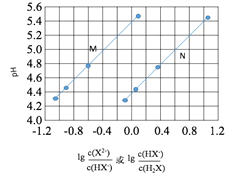
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:

(1)B和A为同系物,B的结构简式为_______。
(2)反应①的化学方程式为___________,其反应类型为__________。
(3)反应③的反应类型为____________。
(4)C的结构简式为___________。
(5)反应②的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
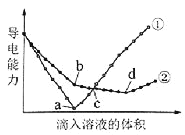
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com