
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:

(1)类比CO2的性质,学习SO2的性质,写出下列反应的离子方程式。
①少量的SO2通入澄清石灰水中:__________________。
②SO2通入Na2SO3溶液中: ________________________。
(2)Y的分子式:___________________。
(3)Z的稀溶液与铁反应的离子方程式为______________________。
(4)检验CO2是否混有SO2,可以使混合气体通过盛有品红溶液的洗气瓶,这是利用了SO2的_____________性,也可以使混合气体通过盛有酸性高锰酸钾稀溶液的洗气瓶,这是利用了SO2的_____________性。
(5)大苏打(Na2S2O3)在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。现欲在实验室制备大苏打,从氧化还原角度分析,合理的是__________(填字母选项)
A.Na2S+S B.Na2SO3+S C.Na2SO3+ Na2SO4 D.SO2+Na2SO4
(6)将X与SO2的水溶液混合后产生淡黄色沉淀,该反应的氧化产物与还原产物的质量之比为__________________
【答案】Ca2++2OH-+SO2=CaCO3↓+H2O SO2+ SO32-+ H2O = 2HSO3- H2SO3 Fe+2H+= Fe2++2H2↑ 漂白 还原 B 2:1
【解析】
根据二氧化硫的性质书写相关离子方程式;根据元素化合价及物质的种类分析判断物质的化学式;根据二氧化硫的漂白性和还原性分析解答;根据氧化还原反应中元素化合价升降规律分析解答。
(1)①SO2属于酸性氧化物,少量的SO2通入澄清石灰水中反应生成亚硫酸钙沉淀和水,离子方程式为:Ca2++2OH-+SO2=CaCO3↓+H2O;
②SO2与Na2SO3反应生成亚硫酸氢钠,离子方程式为:SO2+ SO32-+ H2O = 2HSO3-;
(2)如图所示Y中S元素化合价为+4,则对应的酸为亚硫酸,分子式为:H2SO3;
(3)如图所示Z中S元素化合价为+6,则对应的酸为硫酸,硫酸与铁反应生成硫酸亚铁和氢气,离子方程式为Fe+2H+= Fe2++2H2↑;
(4)二氧化硫具有漂白性,而二氧化碳没有,二氧化硫中S为+4价,能被高锰酸钾氧化,具有还原性,故答案为:漂白;还原;
(5)大苏打(Na2S2O3)中S元素化合价为+2价,
A.Na2S中S为-2价,S中化合价为0,不能都升高为+2价,故A不合理;
B.Na2SO3中S为+4价,S中化合价为0,可以发生歧化反应得到+2的S,故B合理; C.Na2SO3中S为+4价,Na2SO4中S为+6价,不能都降低为+2价,故C不合理; D.SO2中S为+4价,Na2SO4中S为+6价,不能都降低为+2价,故D不合理;
故答案为:B;
(6)将X与SO2的水溶液混合后产生淡黄色沉淀,则X为H2S,淡黄色沉淀为S,反应为2H2S+SO2=3S↓+2H2O,生成的3molS中,2mol由H2S氧化得到,1mol由SO2还原得到,所以氧化产物与还原产物的物质的量之比为:2:1,则质量之比为:2:1,故答案为:2:1。


 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】向下列溶液中加入足量Na2O2后,仍能共存的离子是
A.K+、AlO2-、SO42-、Cl-B.Na+、Cl-、CO32-、SO32-
C.Ca2+、Mg2+、HCO3-、NO3-D.NH4+、Ba2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是用化学方法制得的。方法是向放在温热石棉网上的混合物(NH4NO3和Zn粉)中滴几滴水 ,立即看到白烟。该反应的方程式为:NH4NO3+Zn=ZnO+N2↑+2H2O,下列有关说法中正确的是
A.该反应中NH4NO3只作氧化剂
B.常温常压下每消耗1.3gZn粉,该反应可产生448mL N2
C.常温常压下每生成1mol N2,该反应共转移8 mol电子
D.N2既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):

请回答下列问题:
(l)下列有关说法正确的是______(填选项字母)。
a.化合物A 核磁共振氢谱为两组峰
b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子
d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为________。
(3)D含有的官能团名称为_______,C的同分异构体中具有顺反异构的是______(填名称,不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:_________。
(5)满足下列条件的E的同分异构体W有______种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为________。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代苯,能发生聚合反应
(6)参照上述合成路线,写出以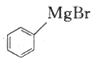 、
、 为主要原料(无机试剂任选),设计制备
为主要原料(无机试剂任选),设计制备 的合成路线:________________________。
的合成路线:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(密度为1.84 g/cm3 )配制100 mL l mol/L的稀硫酸。现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③50 mL烧杯 ④托盘天平 ⑤100 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是.( )
A.④③⑦⑤⑥;B.②⑤⑦⑥;C.①③⑤⑥⑦;D.②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是典型的可充型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
2PbSO4+2H2O。请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加____g。
(2)微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。
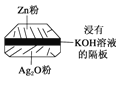
根据上述反应式,完成下列题目。
(1)下列叙述正确的是________。
A.在使用过程中,电解质KOH被不断消耗
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
(2)写出电池的总反应式:___________________________________________________________。
(3)使用时,负极区的pH________(填“增大”“减小”或“不变”,下同),正极区的pH______,电解质溶液的pH________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按下图进行实验,在A中放的是干燥的红色纸条,B中放的是湿润的红色纸条,C中盛放的是氢氧化钠溶液。请回答下列问题。
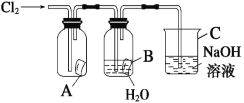
(1)通Cl2一段时间后,A中观察到的现象是_______________,B中观察到的现象是_______________,写出有关反应的化学方程式:_____________________________。
(2)C装置的作用是_____________________________,理由是_______________,写出有关反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是
A. CaO + H2O = Ca(OH)2 B. 3NO2 + 2H2O = 2HNO3+NO
C. 2H2O![]() 2H2↑+O2↑D. 2Na +2H2O =2NaOH+H2↑
2H2↑+O2↑D. 2Na +2H2O =2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:![]() ,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
,该反应一定条件下可自发进行。若反应在恒容密闭容器中进行,下列由该反应作出的判断(有关图像)错误的是( )
A.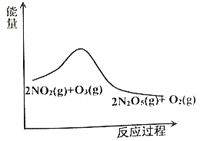 B.
B.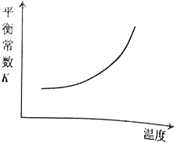
C.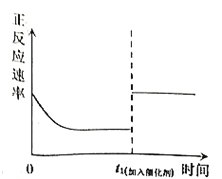 D.
D.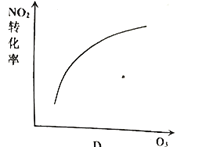
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com