
【题目】有些电影、电视剧中的仙境美轮美奂,这些神话仙境中所需的烟雾是用化学方法制得的。方法是向放在温热石棉网上的混合物(NH4NO3和Zn粉)中滴几滴水 ,立即看到白烟。该反应的方程式为:NH4NO3+Zn=ZnO+N2↑+2H2O,下列有关说法中正确的是
A.该反应中NH4NO3只作氧化剂
B.常温常压下每消耗1.3gZn粉,该反应可产生448mL N2
C.常温常压下每生成1mol N2,该反应共转移8 mol电子
D.N2既是氧化产物又是还原产物
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸的反应为:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
K2S+N2↑+3CO2↑,下列说法中正确的是 ( )
A. 该反应中的还原剂为KNO3
B. 该反应中C被还原
C. 若消耗32g S,该反应转移电子数为2 NA
D. 若生成标准状况下气体22.4L,则有0.75 mol物质被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体所必需的重要矿物质元素,磷的化合物在生产和生活中应用广泛。
反应:P4+ NaOH+H2O→ NaH2PO2 +PH3(未配平)制得的次磷酸钠(NaH2PO2)可作食品防腐剂,也可用于化学镀镍。
请回答下列问题:
(1)磷原子的核外电子排布式:___________;磷原子核外有_____种能量不同的电子。
(2)上述反应的反应物和生成物中含有非极性键的分子是______。(写出物质的化学式)
(3)将Na、O、P三种原子的原子半径大小按由大到小的顺序排列___________________。
(4)NH3的稳定性比PH3的(填“强”或“弱”)_________,判断理由是____________。
(5)A、配平上述反应,并标出电子转移方向与数目_________
P4+ NaOH+ H2O→ NaH2PO2 + PH3
B、上述反应中每生成1mol氧化产物,转移电子的数目为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 mL浓度均为0.1 mol/L的AlCl3与MgCl2混合溶液中,加入60 mL、0.1 mol/L的NaOH溶液后,铝元素的存在形式是
A.Al3+、Al(OH)3B.Al(OH)3C.![]() lO2-、Al(OH)3D.
lO2-、Al(OH)3D.![]() lO2-
lO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度晶体硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。它的制备方法如 下图所示,下列说法正确的是
![]()
A.步骤①的化学方程式为:SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1molSi,转移2mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.单晶硅是电子工业中重要的半导体材料,也能用于制作太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______(填化学式),呈现如此递变规律的原因是________________________________。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___,另一种的晶胞如图二所示,该晶胞的空间利用率为________________(保留两位有效数字)。(![]() )
)
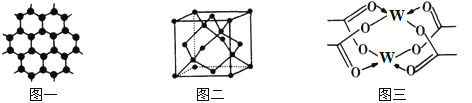
(4)W元素形成的单质,其晶体的堆积模型为___________,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________。请写出上述过程的离子方程式___________________________ ,___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
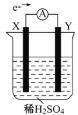
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是
 .
.
A. 外电路的电流方向为:X→导线→Y
B. 若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要维度。下图为硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:

(1)类比CO2的性质,学习SO2的性质,写出下列反应的离子方程式。
①少量的SO2通入澄清石灰水中:__________________。
②SO2通入Na2SO3溶液中: ________________________。
(2)Y的分子式:___________________。
(3)Z的稀溶液与铁反应的离子方程式为______________________。
(4)检验CO2是否混有SO2,可以使混合气体通过盛有品红溶液的洗气瓶,这是利用了SO2的_____________性,也可以使混合气体通过盛有酸性高锰酸钾稀溶液的洗气瓶,这是利用了SO2的_____________性。
(5)大苏打(Na2S2O3)在照相、电影、纺织、化纤、造纸、皮革、农药等方面均有重要用途。现欲在实验室制备大苏打,从氧化还原角度分析,合理的是__________(填字母选项)
A.Na2S+S B.Na2SO3+S C.Na2SO3+ Na2SO4 D.SO2+Na2SO4
(6)将X与SO2的水溶液混合后产生淡黄色沉淀,该反应的氧化产物与还原产物的质量之比为__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
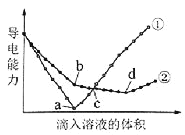
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com