

分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(2)①该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-;
②根据电池总反应判断;
③c电极上氯离子放电生成氯气;根据转移电子相等计算消耗氧气体积;根据“析出什么加入什么”的原则确定加入物质.
解答 解:(1)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ•mol-1
②2CO (g)+O2(g)=2CO2(g)△H=-566.0kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
依据盖斯定律计算:①-②+③×4得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1 ;
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1 ;
(2)①该燃料电池中,通入甲醇的电极是分解、通入氧气的电极是正极,负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
②已知负极反应式为CH3OH-6e-+8OH-=CO32-+6H2O、正极反应式为O2+4e-+2H2O=4OH-,则电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,反应消耗氢氧根离子,所以溶液的pH减小;
故答案为:减小;
③c电极上氯离子放电生成氯气,电极反应式为2Cl--2e-=Cl2↑,乙中电池反应式为2NaCl+2H2O=2NaOH+Cl2↑+H2↑,溶液中生成n(NaOH)=0.1mol/L×0.3L=0.03mol,转移电子的物质的量=0.03mol,串联电路中转移电子相等,所以消耗氧气体积=$\frac{0.03mol}{4}$=168mL;甲中阳极上氢氧根离子放电生成氧气、阴极上铜离子放电生成铜,n(CuSO4)=0.25L×0.04mol/L=0.01mol,铜离子完全放电时转移电子0.02mol<0.03mol,所以阴极上还有部分氢气生成,所以相当于析出CuO和水,可以加入CD使溶液恢复原状,故选CD;
故答案为:2Cl--2e-=Cl2↑;168;CD.
点评 本题考查较综合,题目涉及盖斯定律的应用、原电池和电解池原理的应用等,题目难度中等,注意把握盖斯定律的应用方法以及原电池和电解池中电极方程式的书写方法来分析解答,注意(3)③中阴极上生成的物质,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | a=b=c | B. | c>a>b | C. | a>c>b | D. | a>b>c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 原电池的电极材料中必须至少有一极是金属 | |
| C. | 牺牲阳极的阴极保护法是利用了电解原理 | |
| D. | 用电解法精炼铜时,粗铜作阳极,纯铜作阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含有分子数相同 | B. | 所含有氧原子的个数相等 | ||
| C. | 所含有氢原子的个数不相等 | D. | 所含有原子的总数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有氧元素参与 | |
| B. | 氧化还原反应中所有元素化合价都变化 | |
| C. | 氧化还原反应只有一种元素的化合价变化 | |
| D. | 氧化还原反应中电子有得必有失,化合价有升必有降 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 项目 | 结论 |
| A | 三种有机化合物:丙烯、氯乙烯、苯 | 分子内所有原子均在同一平面 |
| B | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | 属于同一反应类型 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | C5H10O2属于羧酸的同分异构体数目 | 共有4种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
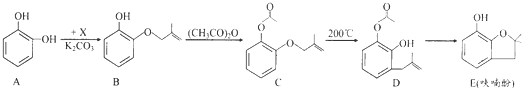
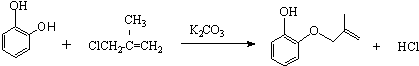 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是硫酸试剂瓶标签上的内容:
如图是硫酸试剂瓶标签上的内容:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有Ba2+ | B. | 乙溶液不含SO42- | C. | 丙溶液含有HCO3- | D. | 丁溶液含有Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com