
【题目】在100℃时,容积为5L的真空密闭容器中加入一定量的N2O4,容器内N2O4和NO2的物质的量变化如下表所示:
时间/s | 0 | 2 | 10 | 30 | 60 | 90 |
n(N2O4)/mol | 0.3 | 0.25 | 0.15 | 0.125 | b | 0.12 |
n(NO2)/mol | 0 | 0.1 | a | 0.35 | 0.36 | 0.36 |
下列说法正确的是( )
A.10s时,以NO2浓度变化表示的该反应速率为0.006molL-1s-1
B.该温度下反应2(NO2g)N2O4(g)的平衡常数K=0.216
C.35s时容器内压强为反应前的1.6倍
D.其它条件不变,90s后向容器中再加入0.3molNO2建立新平衡时,与原平衡时比较,气体平均相对分子质量增大
【答案】D
【解析】
根据表格数据分析,60s时反应已经达到平衡,则b=0.12mol,根据反应N2O4(g) 2NO2(g),10s时,N2O4物质的量的变化量=0.3mol-0.15mol=0.15mol,变化的物质的量之比等于化学计量数之比,则a=0.3mol,据此分析解答。
A.10s内,以NO2浓度变化表示的该反应平均速率为0.006mol·L-1·s-1,10s时为瞬时速率,小于0.006mol·L-1·s-1,故A错误;
B.根据分析,60s时反应达到平衡,平衡时,N2O4为0.12mol,NO2为0.36mol,容积为5L,该温度下反应2NO2(g)N2O4(g)的平衡常数K=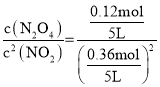 =4.63,故B错误;
=4.63,故B错误;
C.35s时若反应体系达到平衡状态,根据气体的物质的量之比等于压强之比,则![]() =1.6,但根据题中表格数据,35s时容器可能不一定平衡,压强不一定是反应前的1.6倍,故C错误;
=1.6,但根据题中表格数据,35s时容器可能不一定平衡,压强不一定是反应前的1.6倍,故C错误;
D.其它条件不变,90s后向容器中再加入0.3molNO2,因为容器体积不变,充入NO2或N2O4越多,N2O4的体积分数越大,建立新平衡时,与原平衡时比较,气体平均相对分子质量增大,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。CaO2和Na2O2在结构和性质上有很多相似的地方。请完成下列问题:
(1)CaO2属于____(填“离子化合物”或“共价化合物”),其阴、阳离子个数比为______。
(2)CaO2与水反应的化学方程式为______,生成1mol单质气体,转移的电子数为__________。(用NA代表阿伏加德罗常数)
(3)CaO2与二氧化碳反应的化学方程式为_________,该反应属于____________。
A.置换反应 B.氧化还原反应 C.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8 g CO和0.2 g H2在足量的氧气中充分燃烧,使生成的CO2和水蒸气通过过量的过氧化钠,完全反应后固体的质量变化量是( )
A. 增加了3.0 gB. 减少了3.0 gC. 增加了2.6 gD. 减少了2.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
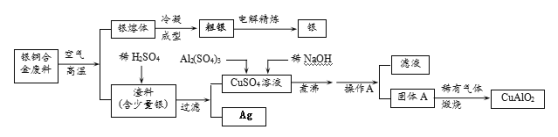
(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是( )
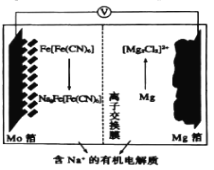
A.放电时,正极反应式:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6]
B.充电时,Mg箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.放电时,Mo箔增加4.6g时,Mg箔减少5.95g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,合理的说法是( )
2H2(g)+S2(g) ΔH>0,合理的说法是( )
A. 加入催化剂,反应途径将发生改变,ΔH也将随之改变
B. 升高温度,正逆反应速率都增大,H2S分解率也增大
C. 增大压强,平衡向逆反应方向移动,将引起体系温度降低
D. 若体系恒容,注入一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定镀锌铁皮锌镀层厚度[ρ(Zn)=7.14gcm-3],某兴趣小组同学截取三块形状规则、大小相近的长方形铁皮(来自同一块镀锌铁皮),量出其长度与宽度,计算得铁片单侧面积;用稀硫酸进行定量试验,数据如下:
实验序号 | 铁片单侧面积/cm2 | 反应前质量/g | 反应后质量/g |
1 | 25.05 | 14.625 | 13.803 |
2 | 24.95 | 14.566 | 13.746 |
3 | 24.89 | 14.489 | 12.789 |
该镀锌铁皮锌镀层厚度为___cm(保留2位有效数字);写出简要计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com