
【题目】以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是( )
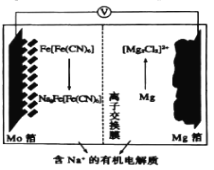
A.放电时,正极反应式:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6]
B.充电时,Mg箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.放电时,Mo箔增加4.6g时,Mg箔减少5.95g
【答案】D
【解析】
根据放电工作原理图,Mo作正极,在正极上发生还原反应:Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6],Mg作负极,负极上是失电子的氧化反应:2Mg+2Cl--4e-=[Mg2Cl2]2+,充电时,原电池的负极连接电源的负极,电极反应和放电时的相反,据此分析解答。
A.根据工作原理,Mg作负极,Mo作正极,放电时,正极反应式为:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6],故A正确;
B.充电时,电池的负极接电源的负极,电池的正极接电源的正极,放电时Mg箔为负极,则充电时,Mg箔接电源的负极作为阴极,故B正确;
C.充电时,Na+通过交换膜移向阴极,即从左室移向右室,故C正确;
D.放电时,由Fe[Fe(CN)6]被还原为Na2Fe[Fe(CN)6],Mo箔增加4.6g时,根据电极反应Fe[Fe(CN)6]+2Na++2e-=Na2Fe[Fe(CN)6],增加的质量为Na的质量,即增加0.2mol的钠,转移0.2mol电子,根据电极反应:2Mg+2Cl--4e-=[Mg2Cl2]2+,转移0.2mol电子,消耗0.1mol的Mg,则Mg箔减少的质量为0.1mol×24g/mol=2.4g,故D错误;
答案选D。


科目:高中化学 来源: 题型:
【题目】有铁的氧化物样品,用150 mL 5 mol/L的盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下氯气1.68L,使其中的Fe2+全部转化为Fe3+,该样品可能的化学式是( )
A.Fe2O3B.Fe3O4C.Fe5O7D.Fe4O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的45倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
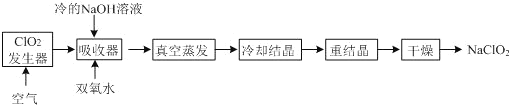
(1)吸收器中反应的离子方程式为________,吸收器中的反应温度不能过高,可能的原因_______。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________。
(3) ClO2发生器中的反应为2NaClO3+SO2+H2SO4═2ClO2+2NaHSO4,实际工业生产中可用硫磺、浓硫酸代替反应原料中的SO2,其原因是______(用化学方程式表示)。
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:
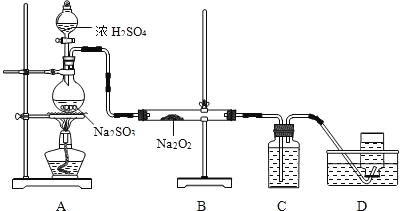
①为除去过量的SO2,C中盛放的试剂为______________。
②D中收集到的气体可使带余烬的木条复燃,B中硬质玻璃管内发生反应的化学方程式为_______。
③有同学认为B中硬质玻璃管内可能还有NaSO4生成。为检验是否有 Na2SO4生成,他们设计了如下方案:
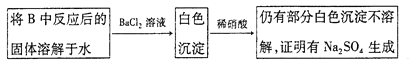
同学们经过讨论,认为上述方案不合理,其理由是:a____________;b_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用NaI溶液中通入少量Cl2得到含碘废液,再利用含碘废液获取NaI固体,实验流程如下:

已知反应②:2I﹣+2Cu2++![]() +H2O
+H2O![]() 2CuI↓+
2CuI↓+![]() +2H+。
+2H+。
回答下列问题:
(1)过滤实验所需要的玻璃仪器有普通漏斗、烧杯、_____________。
(2)反应③中CuI被氧化,还原产物只有NO2,该反应的化学方程式为_________________。当有95.5 g CuI参与反应,则需要标况下______________L的O2才能将生成的NO2在水中完全转化为硝酸。
(3)化合物B中含两种元素,铁原子与另一种元素原子的物质的量之比为3∶8,则化合物B的化学式为_____________。
(4)反应⑤中生成黑色固体和无色气体,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为______。
(5)将足量的Cl2通入含12 g NaI的溶液中,一段时间后把溶液蒸干得到固体的质量为_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.298K时,pH=10的氨水稀释100倍,所得溶液的pH=8
B.298K时,pH=9的CH3COONa溶液和pH=5的盐酸等体积混合,溶液显中性
C.HClO与HF的混合溶液中c(H+)=![]()
D.室温下,等pH的盐酸和氯化铵两种溶液,导电能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,容积为5L的真空密闭容器中加入一定量的N2O4,容器内N2O4和NO2的物质的量变化如下表所示:
时间/s | 0 | 2 | 10 | 30 | 60 | 90 |
n(N2O4)/mol | 0.3 | 0.25 | 0.15 | 0.125 | b | 0.12 |
n(NO2)/mol | 0 | 0.1 | a | 0.35 | 0.36 | 0.36 |
下列说法正确的是( )
A.10s时,以NO2浓度变化表示的该反应速率为0.006molL-1s-1
B.该温度下反应2(NO2g)N2O4(g)的平衡常数K=0.216
C.35s时容器内压强为反应前的1.6倍
D.其它条件不变,90s后向容器中再加入0.3molNO2建立新平衡时,与原平衡时比较,气体平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有如下3个热化学方程式:H2(g)+![]() O2(g)= H2O(g) △H=a kJ/mol,H2(g)+
O2(g)= H2O(g) △H=a kJ/mol,H2(g)+ ![]() O2(g)= H2O(l) △H=b kJ/mol,2H2(g) +
O2(g)= H2O(l) △H=b kJ/mol,2H2(g) + ![]() O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
O2(g)= 2H2O(l) △H=c kJ/mol,关于它们的下列表述正确的是:
A.它们都是吸热反应B.a、b、c均为正值C.a=bD.c=2b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
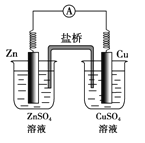
A. 反应中,盐桥中的K+会移向CuSO4溶液
B. 取出盐桥后,电流计依然发生偏转
C. 铜片上有气泡逸出
D. 反应前后铜片质量不改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com