
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
科目:高中化学 来源: 题型:
【题目】将2.5gNa2CO3、NaHCO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加盐酸体积与产生CO2体积(标准状况)关系如图所示,下列说法中错误的是( )
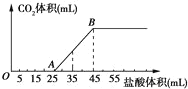
A. OA段发生反应的离子方程式为:H++OH═H2O
B. 当加入35mL盐酸时,产生CO2的体积为224mL
C. B点溶液中的溶质为NaCl
D. 混合物中Na2CO3、NaOH的总质量为2.06g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是( )
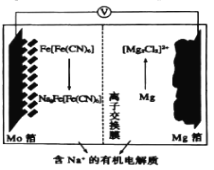
A.放电时,正极反应式:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6]
B.充电时,Mg箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.放电时,Mo箔增加4.6g时,Mg箔减少5.95g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定镀锌铁皮锌镀层厚度[ρ(Zn)=7.14gcm-3],某兴趣小组同学截取三块形状规则、大小相近的长方形铁皮(来自同一块镀锌铁皮),量出其长度与宽度,计算得铁片单侧面积;用稀硫酸进行定量试验,数据如下:
实验序号 | 铁片单侧面积/cm2 | 反应前质量/g | 反应后质量/g |
1 | 25.05 | 14.625 | 13.803 |
2 | 24.95 | 14.566 | 13.746 |
3 | 24.89 | 14.489 | 12.789 |
该镀锌铁皮锌镀层厚度为___cm(保留2位有效数字);写出简要计算过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。溶液中自由移动的离子浓度越大,电导率就越大。如图是向20mL0.01mol/LBa(OH)2溶液中滴入了2滴酚酞溶液,然后向Ba(OH)2溶液中匀速滴加0.2mol/LH2SO4溶液,获得电导率随时间变化的曲线图。
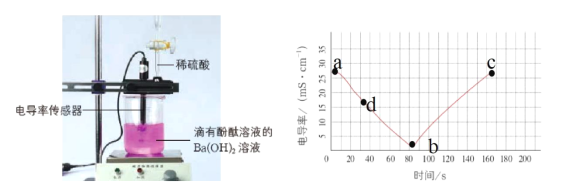
(1)0-80s观察到的实验现象是_____。
(2)写出该实验中的离子方程式_____。
(3)截至b点,加入0.2molL-1H2SO4溶液的体积为_____mL,解释b点的电导率不等于零和bc段电导率又增加的原因____。
(4)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是(_____)(多选题)
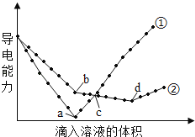
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同量的OH-
E.H+导电能力比Na+强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A.H2、I2、HI平衡混合气加压后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的
C.Fe(SCN)3溶液中加入固体KSCN后颜色变深
D.SO2催化氧化成SO3的反应,往往需要使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
① W![]() X + H2O + CO2↑
X + H2O + CO2↑
② Z + CO2 → X + O2
③ Z + H2O → Y + O2↑
④ X + Ca(OH)2 → Y+ CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W_____________,X_____________,Y_____________,Z_____________。
(2)以上4个化学反应,属于氧化还原反应的是__________________________(填反应序号)。在反应③中氧化剂是___________________(写化学式),还原剂是_____________(写化学式),写出反应②化学方程式并双线桥法标出电子转移方向、数目_______________________________________。
(3)若④反应在溶液中进行,写出其离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表直观地映了元素的性质随着核电荷数的递增呈周期性变化的规律。下图是元素周期表的一部分,请用“A、B、C、D”及“>、<、=”描述元素性质的相关变化关系:

⑴______; ⑵______;⑶______; ⑷______; ⑸______;⑹______;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com