
【题目】如图所示的原电池,下列叙述正确的是(盐桥中装有含琼胶的KCl饱和溶液)( )
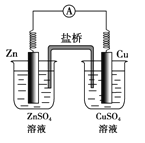
A. 反应中,盐桥中的K+会移向CuSO4溶液
B. 取出盐桥后,电流计依然发生偏转
C. 铜片上有气泡逸出
D. 反应前后铜片质量不改变
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】以Fe[Fe(CN)6]为代表的新型可充电钠离子电池,其放电工作原理如图所示。下列说法不正确的是( )
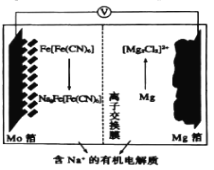
A.放电时,正极反应式:Fe[Fe(CN)6]+2Na++2e-=Na2Fe(Fe(CN)6]
B.充电时,Mg箔接电源的负极
C.充电时,Na+通过离子交换膜从左室移向右室
D.放电时,Mo箔增加4.6g时,Mg箔减少5.95g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。

Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
① W![]() X + H2O + CO2↑
X + H2O + CO2↑
② Z + CO2 → X + O2
③ Z + H2O → Y + O2↑
④ X + Ca(OH)2 → Y+ CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W_____________,X_____________,Y_____________,Z_____________。
(2)以上4个化学反应,属于氧化还原反应的是__________________________(填反应序号)。在反应③中氧化剂是___________________(写化学式),还原剂是_____________(写化学式),写出反应②化学方程式并双线桥法标出电子转移方向、数目_______________________________________。
(3)若④反应在溶液中进行,写出其离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:

(注:Al(OH)3和Cu(OH)2受热易分解成对应的氧化物,且开始分解的温度分别为450℃和80℃)
(1)写出渣料与稀硫酸反应的化学方程式:________________________。
(2)固体混合物A的组成为 、 。
(3)操作A的名称为_______________。
(4)若银铜合金中铜的质量分数为64%,理论上5.0 kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0 molL—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾晶体,其基本操作是 、 、过滤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如下两个反应:
(A)NaOH+HCl=NaCl+H2O
(B)Cu+2Ag+=2Ag+Cu2+

(1)根据两反应本质,判断能否设计成原电池________________________________________。
(2)如果不能,说明其原因_______________________________________________________________。
(3)如果可以,则写出正、负极材料及其电极反应式和反应类型(“氧化反应“或“还原反应):
负极:___________,__________________________,__________;
正极:___________,__________________________,___________;
若导线上转移电子1mol,则正极质量增加_________g,电解质溶液是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表直观地映了元素的性质随着核电荷数的递增呈周期性变化的规律。下图是元素周期表的一部分,请用“A、B、C、D”及“>、<、=”描述元素性质的相关变化关系:

⑴______; ⑵______;⑶______; ⑷______; ⑸______;⑹______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。

(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com