
【题目】20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g/L)如右图所示。下列叙述正确的是

A.盐酸浓度越大,Ksp(PbCl2)越大
B.PbCl2能与一定浓度的盐酸反应
C.x、y两点对应的溶液中c(Pb2+)相等
D.往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s)
科目:高中化学 来源: 题型:
【题目】有关Al与NaOH溶液反应的说法正确的是( )
A.Al是还原剂,NaOH及H2O均是氧化剂
B.还原产物是H2,且由H2O还原所得的H2与NaOH还原所得的H2物质的量之比为2∶1
C.此反应说明铝具有两性,铝的活泼性比只具有金属性的金属弱
D.此反应中,只有水是氧化剂,NaOH既不是氧化剂也不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠是一种重要的化工产品,利用氨碱法生产纯碱的流程如下图所示。

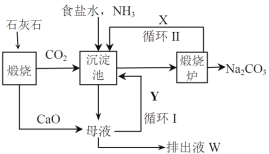
(1)沉淀池中发生反应的化学方程式为___________________;
(2)X是________,Y是_______(填化学式);
(3)排出液W中的溶质除了氢氧化钙外,还有_______、________;(至少两种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应的反应热。

回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎泡沫塑料的作用是________________。
(3)大烧杯上如不盖硬纸板,求得的中和反应的反应热的数值________(填“偏大”“偏小”或“无影响”)。
(4)实验中改用55 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1 NaOH溶液进行反应,与上述实验相比,所放出的热量________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和反应的反应热会________(填“偏大”“偏小”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D.容器Ⅰ、Ⅱ中正反应速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
元素 | X | Y | Z |
最高、最低化合价 | +7 -1 | +6 -2 | +5 -3 |
A. 原子序数:X>Y>Z
B. 原子半径:X>Y>Z
C. 稳定性:HX>H2Y>ZH3
D. 酸性由强到弱:HXO4>H2YO4>H3ZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL 煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(4)丙组同学取10 ml 0.1 mol·L-1KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取 2 mL 此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有______(填离子符号),由此可以证明该氧化还原反应为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应的△H=+120KJ/mol△S=100J/(mol·k),则该反应能自发进行的是
A.仅在高温下
B.在任何温度下都不能自发进行
C.在任何温度下
D.仅在低温下
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com