
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
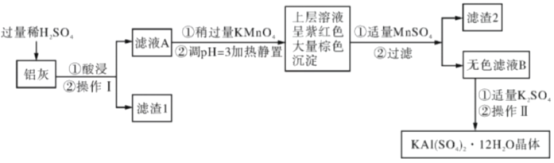
(1)明矾净水的原理是____________(用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________,滤渣2含有的物质是_______________。
【答案】Al3++3H2O![]() Al(OH)3(胶体)+3H+ 冷却结晶 洗涤 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O=5MnO2↓+4H+ MnO2、Fe(OH)3
Al(OH)3(胶体)+3H+ 冷却结晶 洗涤 酸性高锰酸钾溶液(或铁氰化钾溶液) 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 3Mn2++2MnO4-+2H2O=5MnO2↓+4H+ MnO2、Fe(OH)3
【解析】
(1)明矾净水的原理主要是铝离子水解生成氢氧化铝胶体。
(2)操作Ⅱ从溶液到晶体的过程是蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是用酸性高锰酸钾,溶液褪色。
(4)将铝灰投入氢氧化钠溶液中生成气体,主要是铝和氢氧化钠反应生成偏铝酸钠和氢气,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,在滤液A中加入高锰酸钾发生反应生成锰离子和铁离子,其离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(5)加入MnSO4发生反应主要是锰离子和高锰酸根离子反应生成二氧化锰,再根据氧化还原反应得到其离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,滤渣2含有的物质是亚铁离子被氧化成铁离子而变为氢氧化铁,还有反应生成的二氧化锰。
(1)明矾净水的原理主要是铝离子水解生成氢氧化铝胶体,Al3++3H2O![]() Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O
Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+。
Al(OH)3(胶体)+3H+。
(2)操作Ⅱ从溶液到晶体的过程是蒸发浓缩、冷却结晶、过滤、洗涤、干燥,故答案为:冷却结晶;洗涤。
(3)检验滤液A中是否存在Fe2+的试剂是用酸性高锰酸钾,溶液褪色,故答案为:酸性高锰酸钾溶液(或铁氰化钾溶液)。
(4)将铝灰投入氢氧化钠溶液中生成气体,主要是铝和氢氧化钠反应生成偏铝酸钠和氢气,其化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,在滤液A中加入高锰酸钾发生反应生成锰离子和铁离子,其离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
(5)加入MnSO4发生反应主要是锰离子和高锰酸根离子反应生成二氧化锰,再根据氧化还原反应得到其离子方程式为3Mn2++2MnO4-+2H2O=5MnO2↓+4H+,滤渣2含有的物质是亚铁离子被氧化成铁离子而变为氢氧化铁,还有反应生成的二氧化锰,故答案为:MnO2、Fe(OH)3。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】化合物X经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2,X的核磁共振氢谱有4组峰且峰面积之比为1:2:2:3,X分子中只含一个苯环,且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图。下列关于X的说法中不正确的是( )
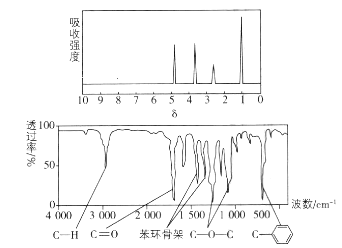
A.X分子属于酯类化合物,在一定条件下能发生水解反应
B.X在一定条件下可与3mol H2发生加成反应
C.符合题中X分子结构特征的有机物只有1种
D.与X属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(Fe2O3)是一种常见颜料,用废铁屑制取铁红的工艺如图:

(1)写出废铁屑中的铁和稀硫酸反应的离子方程式:_____。
(2)“沉淀”反应中除生成FeCO3外,还生成一种能使澄清石灰水变浑浊的气体,该气体为_____。
(3)检验滤液中含有![]() 的方法是_____。
的方法是_____。
(4)“煅烧”时FeCO3与O2反应的物质的量之比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时拟用0.10mol/L的氢氧化钠溶液滴定10mL浓度为0.10mol/L醋酸的滴定曲线如图所示。横坐标为加入氢氧化钠的体积,纵坐标为溶液的pH。回答下列问题:
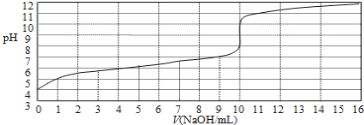
(1)该醋酸溶液的电离度α=______________。
(2)写出pH=7时溶液中离子浓度的大小关系:__________________________ 。
(3)为了准确指示终点本次滴定最好选用________做指示剂。
(4)写出滴入5mL氢氧化钠溶液时,溶液中的物料守恒关系:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子的立体构型可用sp2杂化轨道来解释的是
①BF3 ②CH2═CH2 ③苯 ④CH≡CH ⑤NH3 ⑥CH4 ⑦HCHO.
A. ①②③⑦ B. ①②③⑤ C. ②③④⑦ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法中正确的是( )
①1mol Na2O 和 Na2O2 混合物中含有的阴、阳离子总数是 3NA
②常温常压下,92g的NO2和N2O4 混合气体含有的原子数为 6NA
③7.8 g![]() 中含有的碳碳双键数目为 0.3 NA
中含有的碳碳双键数目为 0.3 NA
④用 1L1.0 mol/LFeCl3 溶液制备氢氧化铁胶体,所得氢氧化铁胶粒的数目为 NA
⑤1mol SO2与足量O2在一定条件下充分反应生成 SO3,共转移 2NA个电子
⑥在反应 KIO3+6HI=KI+3I2+3H2O 中,每生成 3molI2 转移的电子数为 5NA
A.①②③B.②③④C.①②⑥D.④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:Mg5Al3(OH)19(H2O)4![]() H2O↑+MgO+A12O3
H2O↑+MgO+A12O3
(1)请配平方程式_______________________。
(2)写出该化合物作阻燃剂的两条依据______。
(3)已知MgO可溶于NH4Cl的水溶液,其原理为______(用化学方程式和必要的文字说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金只含铝、铁、铜三种元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反应,放出无色气体11.2L(标准状况下)。将反应后的溶液分成2等份,向一份溶液中滴加![]() ,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的
,无明显现象。向另一份溶液中滴加氨水至过量,过滤得沉淀bg,充分灼烧得固体cg,减轻了5.4g,再加入到过量的![]() 溶液中,剩余不溶物dg。下列说法不正确的是
溶液中,剩余不溶物dg。下列说法不正确的是
已知;![]() 遇到
遇到![]() 会出现蓝色沉淀。
会出现蓝色沉淀。
A. ![]()
B. 原合金中铜的质量为![]()
C. 若将上述![]() 稀硝酸逐滴加入到合金中,放出气体仍为
稀硝酸逐滴加入到合金中,放出气体仍为![]() (标准状况下)
(标准状况下)
D. d不是一确定值,可能为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molN2与3molH2混合充入2L的恒容密闭容器中,在一定条件下发生反应:N2(g)+3H2(g)![]() 2NH3(g)。经2min后测得NH3的物质的量为0.6mol。下列说法正确的是
2NH3(g)。经2min后测得NH3的物质的量为0.6mol。下列说法正确的是
A.反应速率v(NH3)=0.3mol/(L·min)B.2min时,c(N2)=0.7mol/L
C.2min时,H2的转化率为30%D.2min时,气体压强变为反应前的![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com