
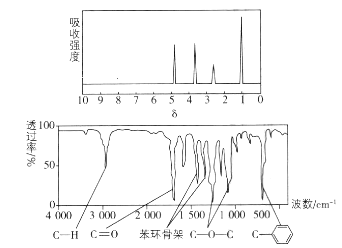
【题目】化合物X经李比希法和质谱法分析得知其相对分子质量为136,分子式为C8H8O2,X的核磁共振氢谱有4组峰且峰面积之比为1:2:2:3,X分子中只含一个苯环,且苯环上只有一个取代基,其红外光谱与核磁共振氢谱如图。下列关于X的说法中不正确的是( )
A.X分子属于酯类化合物,在一定条件下能发生水解反应
B.X在一定条件下可与3mol H2发生加成反应
C.符合题中X分子结构特征的有机物只有1种
D.与X属于同类化合物的同分异构体只有2种
【答案】D
【解析】
有机物X的分子式为C8H8O2,不饱和度为![]() =5,且X分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,苯环上有三类氢原子,个数分别为1、2、2,所以剩余侧链上的3个氢等效,为-CH3,结合红外光谱可知,分子中存在酯基,故有机物X的结构简式为
=5,且X分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,苯环上有三类氢原子,个数分别为1、2、2,所以剩余侧链上的3个氢等效,为-CH3,结合红外光谱可知,分子中存在酯基,故有机物X的结构简式为![]() ,据此解答。
,据此解答。
有机物X的分子式为C8H8O2,不饱和度为![]() =5,且X分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,苯环上有三类氢原子,个数分别为1、2、2,所以剩余侧链上的3个氢等效,为-CH3,结合红外光谱可知,分子中存在酯基,故有机物X的结构简式为
=5,且X分子中只含一个苯环且苯环上只有一个取代基,其核磁共振氢谱有四个吸收峰,说明分子中含有4种H原子,苯环上有三类氢原子,个数分别为1、2、2,所以剩余侧链上的3个氢等效,为-CH3,结合红外光谱可知,分子中存在酯基,故有机物X的结构简式为![]() ;
;
A.X 中含有酯基,可以发生水解,故A正确;
B.1mol有机物X含有1mol苯环,可以与3mol氢气发生加成反应,故B正确;
C.由上述分析可知,符合条件的有机物X的结构简式为![]() ,故C正确;
,故C正确;
D.X属于同类化合物,应含有酯基、苯环,若为羧酸与醇形成的酯有:甲酸苯甲酯,若为羧酸与酚形成的酯,可以是乙酸酚酯,可以是甲酸与酚形成的酯,甲基有邻、间、对三种位置,故5种异构体,故D错误;
故答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是利用盐桥电池从某些含碘物质中提取碘的两个装置,下列说法中正确的是( )
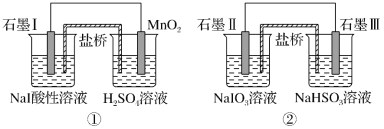
A.两个装置中,石墨I和石墨Ⅱ均作负极
B.碘元素在装置①中被还原,在装置②中被氧化
C.装置①中MnO2的电极反应式为MnO2+2H2O+2e-=Mn2++4OH-
D.装置①、②中的反应生成等量的I2时,导线上通过的电子数之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】6.4g铜投入一定浓度的HNO3中,铜完全溶解,生成NO和NO2的混合气体,用试管全部收集,得到标准状况下的体积为2240mL。请回答:
(1)反应中消耗掉HNO3的物质的量为___mol。
(2)生成NO2的体积(标况)为___mL。
(3)将盛有混合气体的试管倒扣在水槽中,通入标况下的O2,恰好使气体完全溶于水中,则通入O2的体积是___mL。(请写出解答过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铜片、银片、Cu (NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池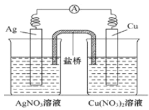 。以下有关该原电池的叙述正确的是( )
。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①②B.②③C.②④D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是
A. 甲、乙、丙三种物质都含有氮元素 B. 反应Ⅱ、Ⅲ和Ⅳ的氧化剂相同
C. Ⅵ的产物可在上述流程中被再次利用 D. 丁为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.纯过氧化氢是淡蓝色的黏稠液体,可与水以任意比混合,水溶液俗称双氧水,为无色透明液体。实验室常用过氧化氢制取氧气,工业上过氧化氢是重要的氧化剂和还原剂,常用于消毒、杀菌、漂白等。某化学兴趣小组的同学围绕过氧化氢开展了调查研究与实验,请你参与其中一起完成下列学习任务:
(1)写出过氧化氢的电子式:____________。
(2)实验室中用过氧化氢制取氧气的化学方程式为_______________,当生成标准状况下2.24L O2时,转移电子为______ mol。
(3)该兴趣小组的同学查阅资料后发现H2O2为二元弱酸,其酸性比碳酸弱。请写出H2O2在其水溶液中的电离方程式:______。(只写第一步)
(4)同学们发现向滴加了酚酞的NaOH溶液中加入H2O2后,溶液中红色消失。关于褪色原因:甲同学认为H2O2是二元弱酸,消耗了OH-使红色消失;乙同学认为H2O2具有漂白性使溶液褪色。请设计一个简单的实验方案来判断甲、乙两位同学的说法是否正确:___________
Ⅱ.工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
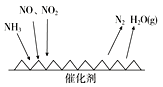
(1)由上图可知SCR技术中的氧化剂为________。
(2)用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________________________________
Ⅲ.研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应①:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
CH3OH(g)+H2O(g) △H1= -49.6 kJ/mol
反应②:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2= +23.4 kJ/mol
2CH3OH(g) △H2= +23.4 kJ/mol
反应③:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=___________kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中的信息判断,下列说法错误的是

A. 第①组反应的氧化产物为O2
B. 第②组反应中C12与FeBr2的物质的量之比小于或等于1:2
C. 第③组反应中生成3mol C12,转移6mol电子
D. 氧化性由强到弱的顺序为C1O3- >C12>Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
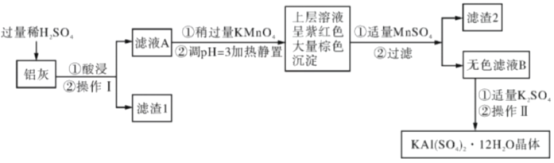
(1)明矾净水的原理是____________(用离子方程式表示)。
(2)操作Ⅱ是蒸发浓缩、__________、过滤、__________、干燥,
(3)检验滤液A中是否存在Fe2+的试剂是________________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是_________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):________
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:_________________,滤渣2含有的物质是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com