
【题目】常温下,将0.1000mol/L的NaOH溶液分别滴加到20.00mL浓度均为0.1000mol/L的一元酸HX和HY溶液中,溶液的pH与所加NaOH体积的关系如图所示,下列叙述错误的是
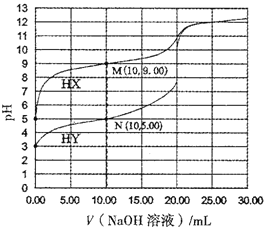
A. N点溶液中c(Y-)>c(Na+)>c(OH-)>c(H+)
B. 常温下,0.1000mol/LHY溶液的电离度约为1%
C. Ka(HX)数量级为10-9
D. 用NaOH溶液滴定HY可用酚酞做指示剂
【答案】A
【解析】
A、N点时所得溶液为含有等物质的量的HY和NaY的混合溶液,溶液呈酸性,HY电离大于Y-的水解,c(Y-)>c(Na+)>c(H+)>c(OH-),故A错误;
B、由图可知,常温下,0.1000mol/LHY溶液的pH=3,HY溶液的电离度约为10-3mol/L÷0.1000mol/L×100%=1%,故B正确;
C、由图可知,常温下,0.1000mol/LHX溶液的pH=5,HX电离平衡常数Ka=c(H+)c(X-)/c(HX)=10-5×10-5/0.1000=10-9,故C正确;
D、NaY为强碱弱酸盐,水解使溶液呈碱性,应选用碱性范围变色的指示剂,所以用NaOH溶液滴定HY时可用酚酞做指示剂,故D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】从海水提取镁和溴的流程如下,请回答相关问题。

(1)海水进入沉淀池前,对海水进行处理有以下两种方案:
方案一:将晒盐后的卤水通入沉淀池;
方案二:将加热蒸发浓缩后的海水通入沉淀池。
你认为方案_________更合理。操作1的名称_________。
(2)提取镁和溴
①试剂a为_________(填化学式),通入试剂a发生反应的离子方程式_________。
②吹出塔中通入热空气的目的是_________。
③吸收塔中发生反应离子方程式是_________。
④无水MgCl2制备Mg的化学方程式是_____。
(3)提取溴的过程中,经过2次Br-→Br2转化的目的是__。
(4)从海水中提取溴的工艺也可以按如下图所示(框图中是主要产物):

i. 过程③中反应的离子方程式是________。
ii. 若最终得到的溴单质中仍然混有少量的Cl2,应加入_________将其除去。
A. NaI B. NaBr C. SO2 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,1-二环丙基乙烯(![]() )是重要医药中间体,下列关于该化合物的说法错误的是
)是重要医药中间体,下列关于该化合物的说法错误的是
A. 所有碳原子不能在同一平面 B. 能被酸性髙锰酸钾溶液氧化
C. 二氯代物只有3种 D. 生成1 molC8H18至少需要3molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:
CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
N2(g)+CO2(g)+2H2O(g) ΔH=a kJ/mol
在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法不正确的是
A. 10 min内,T1时v(CH4)T2时小 B. 温度:T1<T2
C. ΔH:a < 0 D. 平衡常数:K(T1)<K(T2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛在木材加工、医药等方面有重要用途。甲醇直接脱氢是工业上合成甲醛的新方法,制备过程涉及的主要反应如下:
反应I:CH3OH(g)![]() HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
HCHO(g)+H2(g) △H1=+85.2kJ·mol-1
反应II:CH3OH(g)+1/2O2(1)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
反应III:H2(g)+1/2O2(g)![]() H2O(g) △H3=-241.8kJ·mol-1
H2O(g) △H3=-241.8kJ·mol-1
副反应:
反应IV:CH3OH(g)+O2(g)![]() CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
CO(g)+2H2O(g) △H4=-393.0kJ·mol-1
(1)计算反应Ⅱ的反应热△H2=____________________________________________。
(2)750K下,在恒容密闭容器中,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为P0,达到平衡转化率为α,则平衡时的总压强P平=___________(用含P0和α的式子表示);当P0=101kPa,测得α=50.0%,计算反应平衡常数Kp=___________kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)Na2CO3是甲醇脱氢制甲醛的催化剂,有研究指出,催化反应的部分机理如下:
历程i:CH3OH→H+·CH2OH
历程ⅱ:·CH2OH→·H+HCHO
历程ⅲ:·CH2OH→3·H+CO
历程iv:·H+·H→H2
下图表示一定条件下温度对碳酸钠催化脱氢性能的影响,回答下列问题:
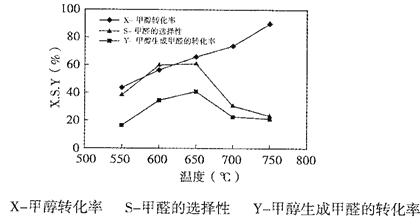
①从平衡角度解析550℃-650℃甲醇生成甲醛的转化率随温度升高的原因___________;
②反应历程i的活化能___________(填“>、“<”或“=”)CH3OH(g)![]() HCHO(g)+H2(g)活化能。
HCHO(g)+H2(g)活化能。
③650℃~750℃,反应历程ii的速率___________(填“>”、“<”或“=”)反应历程ⅲ的速率。
(4)吹脱是处理甲醛废水的一种工艺,吹脱速率可用方程v=0.0423c(mg·L-1·h-1)表示(其中c为甲醛浓度),下表为常温下甲醛的浓度随吹脱时间变化数据。
浓度(mg/L) | 10000 | 8000 | 4000 | 2000 | 1000 |
吹脱时间(h) | 0 | 7 | 23 | 39 | 55 |
则当甲醛浓度为2000mg/L时,其吹脱速率v=___________ mg·L-1·h-1,分析上表数据,起始浓度为10000mg/L,当甲醛浓度降为5000mg/L,吹脱时间为___________h。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
回答下列问题:
(1)仪器A的名称为_________________________。
(2)倒入NaOH溶液的正确操作是________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止 温度 t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | _______ |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似地认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃),则中和热ΔH = ______ (取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是________。
A.用滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如下:
温度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①写出工业合成氨的化学方程式_________。
②由上表数据可知该反应为放热反应,理由是_________。
③理论上,为了增大平衡时H2的转化率,可采取的措施是_________。(填序号)
a. 增大压强 b. 使用合适的催化剂
c. 升高温度 d. 及时分离出产物中的NH3
(2)原料气H2可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g)获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如下图所示:
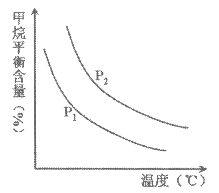
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②该反应为________反应(填“吸热”或“放热”)。
(3)原料气H2还可通过反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
CO(g)+3H2(g)获取。T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1
①平衡时CO的转化率为_________。
②该温度下反应的平衡常数K值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%,二氧化碳(CO2)的排放量也要大幅减少。

(1)在恒温,容积为1 L容器中,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
2SO3(g) ΔH=-196.6 kJ·mol-1,回答下列问题:
①写出能表示硫的燃烧热的热化学方程式: _____________________________
②ΔH2=__________kJ·mol-1。
③在相同条件下,充入1 mol SO3和0.5 mol的O2,则达到平衡时SO3的转化率为___________;此时该反应________(填“放出”或“吸收”)________kJ的能量。
(2)中国政府承诺,到2020年单位GDP二氧化碳排放比2005年下降40%~50% 。
①CO2可转化成有机物实现碳循环。在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1,测得CO2和CH3OH(g)浓度随时间变化如图2所示。从3 min到9 min,v(H2)=________mol·L-1·min-1。此条件下该反应的平衡常数为__________

②能说明上述反应达到平衡状态的是______(填编号)
A、反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B、混合气体的密度不随时间的变化而变化
C、CO2的体积分数在混合气体中保持不变
D、单位时间内消耗3 mol H2,同时消耗1 mol H2O
③为了加快化学反应速率且使体系中气体的物质的量减少,其他条件不变时,可采取的措施有________(填编号)。
A.升高温度B.缩小容器体积C.再充入CO2气体D.使用合适的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com