
【题目】已知HA为一元酸,常温下向20mL0.01mol/L的HA溶液中滴加0.01mol/L的NaOH溶液,测得溶液pH与所加NaOH溶液体积关系如图所示。下列说法不正确的是

A. 常温下,该酸的电离常数K=10-5.6
B. 该测定过程中不可以选择甲基橙为指示剂
C. 滴定至①处时,溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-)
D. 由①到③过程中,水的电离程度先增大后减小
【答案】D
【解析】根据0.01mol/L的HA溶液pH大于2可以知道HR为弱酸,该过程为一元强碱滴定一元弱酸的过程,①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;②点溶液中呈中性;③点溶液是二者恰好完全反应生成NaA,强碱弱酸盐,溶液显碱性;酸碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用,以此分析解答。
详解:A. HA![]() H++A-,pH=3.8,c(H+)=10-3.8,该酸的电离常数K=
H++A-,pH=3.8,c(H+)=10-3.8,该酸的电离常数K=![]() =
=![]() =10-5.6,故A正确;
=10-5.6,故A正确;
B.该测定为强碱滴弱酸,反应完全时,生成强碱弱酸盐,溶液显碱性,应该选择酚酞为指示剂,若选用甲基橙为指示剂,因甲基橙变色范围3.1![]() 4.4,误差较大,故B正确;
4.4,误差较大,故B正确;
C. ①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;HA的电离大于A-水解,则溶液中离子浓度关系为:c(A-)>c(Na+)>c(H+)>c(OH-),故C正确;
D. 在①、②、③点对应的溶液中, ①点溶液为等浓度的HA和NaA的混合溶液,且溶液显酸性;②点溶液中呈中性;③点溶液是二者恰好完全反应生成NaA,强碱弱酸盐,溶液显碱性;酸碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用,所以由①到③过程中,水的电离程度逐渐增大,故D错误;
综上所述,本题正确答案为D。


科目:高中化学 来源: 题型:
【题目】(原创)下列说法不正确的是( )
A.中和热测定实验中,应迅速将NaOH溶液和盐酸在测定装置中混合
B.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
C.探究催化剂对H2O2分解速率的影响:在相同条件下,向一支试管中加入2mL 5%H2O2和1mL H2O,向另一支试管中加入2mL 5%H2O2和1mL FeCl3溶液,观察并比较实验现象
D.已知![]() ,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液
,为了利用该反应探究反应速率与温度的关系,所用试剂除1 mol·L-1KI溶液、0.1 mol·L-1稀硫酸外,还需要用到淀粉溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1,将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g);△H<0。当反应进行到时间 t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。 试回答:
2SO3(g);△H<0。当反应进行到时间 t0时达到平衡状态,测得混合气体的总物质的量为2.1 mol。 试回答:

(1)t0时SO3的物质的量为:____________,在图2中作出反应混合物中各组分气体的物质的量随反应进行到t0时的变化曲线____________;
(2)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度为T2 (T2>T1),反应在t3时(t3>t1)重新达到平衡状态,新平衡混合物中气体的总物质的量________2.1 mol(填“<”、“>”或“=”)。
(3)如图1所示,若起始时在容器中加入0.6 mol SO2、0.3 mol O2 ,保持温度不变,达到平衡状态后,SO3气体的体积分数与上述平衡相比__________(填“<”、“>”或“=”)。。
(4)V2O5是上述反应的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化。写出该催化循环机理的化学方程式________,_______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列反应方程式(请注明反应条件),并按要求填空
(1)实验室制备乙烯_______________,反应类型是___________.
(2)乙酸与乙醇的反应______________,反应的无机产物中氧元素的来源是________。
(3)溴乙烷与氢氧化钠水溶液共热_____________,此反应将卤代烃类物质转化为______类物质.
(4)苯与浓硫酸、浓硝酸的混合酸在加热时发生反应__________,反应类型是___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是

A.该装置工作时,H+由b极区流向a极区
B.该制氢工艺中光能最终转化为化学能
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为原子序数依次增大的短周期主族元素,其原子半径与最外层电子数的关系如下图1。E原子最外层上的电子数是D原子最外层电子数的4倍,D离子核外电子排布与C2-相同。

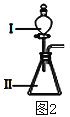
试回答:
(1)元素E在元素周期表中的位置是___________________。
(2)与元素D离子所含电子数和质子数均相同的微粒是________________。(用化学式作答,下同)
(3)B和E最高价氧化物对应的水化物,酸性较弱的_________________。若用上图2中装置验证这两种酸的酸性强弱,则在装置中加入的试剂分别为:Ⅰ___________,Ⅱ__________,观察到的实验现象是________________________。
(4)由以上五种元素组成的物质,其组成和结构信息如下表:
物质 | 组成和结构信息 |
a | 含有A、C、D的盐 |
b | C、D组成的化合物,且原子数之比为1∶1 |
c | 化学组成为AC2 |
①a含有的化学键有___________________________________;
②b与c反应的化学方程式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装量制取少量澳苯并证明该反应是取代反应。请回答:

(1)仪器A的名称为____________,冷凝水的进水口为_________,(填“m”或“n”)。
(2)制取溴苯的化学方程式为___________________。
(3)锥形瓶中足量NaOH溶液的作用是_________。
(4)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出_________。
(5)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用__________(填仪器名称)分离出溴苯(仍含有少量苯)。
(6)设计实验证明制取溴苯的反应是取代反应___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为14.4 g,若其中水的质量为7.2 g,则CO的质量是 ( )。
A. 2.8 gB. 4.4 gC. 5.6 gD. 在2.8 g~5.6 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 。室温下用
。室温下用![]() 的
的![]() 滴定
滴定![]() 某一元酸
某一元酸![]() 的结果如图所示,下列说法中正确的是
的结果如图所示,下列说法中正确的是

A. ![]() 属于弱酸
属于弱酸
B. 整个过程中,![]() 点时水的电离程度最大
点时水的电离程度最大
C. ![]() 点对应液中
点对应液中![]()
D. ![]() 的数量级为
的数量级为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com