
【题目】某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物![]() 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:铜铝混合物![]() 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或氢氧化钠溶液
B.溶液A和B均可以选用稀硝酸
C.若溶液B选用氯化铁溶液,则实验难以实现
D.实验方案Ⅱ更便于实施
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,氧化剂与还原剂的物质的量之比是_____,当有2molHNO3参加反应时,被氧化的物质是____g,电子转移数目约为_____个。
(2)在反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
(3)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为不可能实现的是______。
(4)今有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最强的物质的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL浓度为0.05mol·L-1的Na2SO3溶液恰好与25mL浓度为0.02mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰苯胺是用途广泛的化工原料,主要应用于医药、日用化工等诸多领域。某兴趣小组制备流程如下:
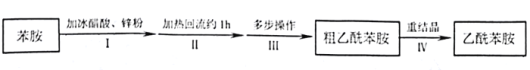
已知:
a.乙酰苯胺在水中的溶解度随温度的升高而增大
b.苯胺在空气中受热易被氧化
c.
名称 | 苯胺 | 醋酸 | 乙酰苯胺 |
沸点 | 184.4 | 117.9 | 304 |
d.反应原理:![]() +CH3COOH
+CH3COOH ![]()
![]() +H2O
+H2O
请回答:
(1)步骤Ⅰ,加入锌粉的目的__________。
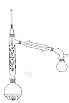
(2)步骤Ⅱ实验装置如图(加热装置省略),具体实验过程:装上一刺形分馏柱,插上温度计。用酒精灯加热,使反应溶液在微沸状态下回流,调节加热温度,使柱顶温度105℃左右,反应约![]() 。在反应瓶上装一个刺形分馏柱,其作用是__________。
。在反应瓶上装一个刺形分馏柱,其作用是__________。
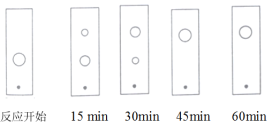
(3)步骤Ⅱ某同学采用薄层色谱(原理和操作与纸层析类同)跟踪反应进程,分别在反应开始、回流![]() 、
、![]() 、
、![]() 和
和![]() 时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
时,用毛细管取样、点样、薄层色谱展开后的斑点如图所示。该实验条件下比较合适的回流时间是______。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(4)步骤Ⅳ,关于重结晶的操作,下列说法正确的是________。
A.选蒸馏水作为重结晶提纯乙酰苯胺的溶剂
B.粗制的有机化合物中常常含有有色杂质,可用活性炭进行脱色
C.趁热过滤时,需将菊花形滤纸放入长颈玻璃漏斗,一并放入保温漏斗中
D.趁热过滤也可以用减压过滤代替,提前将布氏漏斗放在沸腾的水浴中加热,防止乙酰苯胺热溶液遇到冷的布氏漏斗而提前析出。
E.冷却结晶时一般是在室温下自然冷却。当溶液降至室温,析出大量乙酰苯胺晶体后,可用冰水进一步冷却,以便晶体析出更加彻底。
(5)物质制备时,通常对纯度有一定要求,从结构与性质角度分析,上述制备过程中“由非氧化还原反应”产生的杂质可能有__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法错误的是

A. 该装置是将化学能转变为电能
B. 每得到1 mol草酸铝,电路中转移3mol电子
C. 正极的电极反应:2CO2 + 2e-=== C2O42-
D. 利用该技术可捕捉大气中的CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅酸盐及无机非金属材料的说法正确的是
A. 硅酸钠属于盐,不属于碱,所以硅酸钠水溶液可以保存在磨口玻璃塞试剂瓶中
B. 反应①Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,反应②Na2CO3+SiO2 ![]() Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都能发生
C. 普通玻璃、石英玻璃、水泥等均属于硅酸盐材料
D. 祖母绿的主要成分为Be3Al2Si6O18,用氧化物形式表示为3BeO·Al2O3·6SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
(1)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是___。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
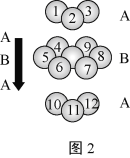
(2)2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。

①用A、B、O表示这类特殊晶体的化学式:___。
②已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁—铁磁、铁磁—顺磁转变及金属—半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:___。(用含x的代数式表示)
③Mn的核外电子排布式为:___。
④下列有关说法正确的是___。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用Zn与实验室中的盐酸反应制取4.48L H2(标准状况)。
(1)如果选用所贴标签为2.0mol·L-1的盐酸,至少需该盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g·mL-1)的盐酸,至少需该盐酸多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉在社会生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。洪水过后,灾区人们的饮用水必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会呈稀粥状而失效。
(1)漂白粉可用来漂白或杀菌消毒,用化学方程式表示其原理:________________。
(2)用化学方程式表示漂白粉在空气中易失效的原因:________________________。
(3)已知浓盐酸和次氯酸钙能发生如下反应:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com