
【题目】《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是

A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】芳香族化合物A(![]() )是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:
)是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:

(1)A的分子式是______,B含有的官能团的名称是_________。
(2)D→E的反应类型是_________。
(3)已知G能与金属钠反应,则G的结构简式为________。
(4)写出E→F的化学方程式:_________。
(5)龙胆酸D的同分异构体有多种,符合下列条件的有___种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:____。
①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2mol Na2CO3反应。
(6)已知: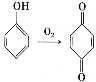 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(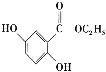 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硼(BN)是一种重要的功能陶瓷材料以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
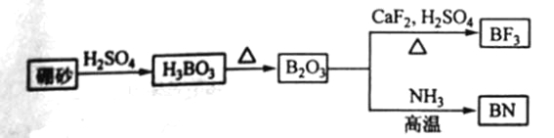
请回答下列问题:
(1) 由B2O3制备BF3、BN的化学方程式依次是_________、__________;
(2) 基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________;
(3) 在BF3分子中,F-B-F的建角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF,BF的立体结构为_______;
(4) 在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________;
(5)六方氢化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶苞边长为361.5pm,立方氮化硼晶苞中含有______各氮原子、________各硼原子,立方氮化硼的密度是_______g·![]() (只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的溶液在蒸发皿中加热蒸干并灼烧,可以得到该物质本身的是( )
①CuSO4;②KHCO3;③FeSO4;④NH4Cl;⑤MgSO4;⑥AlCl3 ;
A. ①③ B. ①⑤ C. ①③⑤ D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
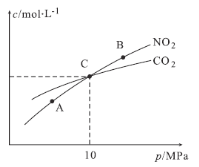
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+ 4CO(g)![]() CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。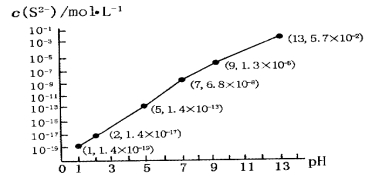
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生反应 mA(g)+nB(g)![]() pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
pC(g)达到平衡后,温度不变,将气体体积缩小到原来的1/3,达到平衡时,C的浓度为原来的2.5倍,则下列说法正确的是
A. C的体积分数增加 B. A的转化率降低
C. 平衡向正反应方向移动 D. m+n>p
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A2+B2![]() 2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;c为300℃时,从t3时刻开始向容器中加压的情况。则下列叙述正确的是( )
2AB,在温度或压强改变时,AB%的变化如图所示。a为500℃、b为300℃时的情况;c为300℃时,从t3时刻开始向容器中加压的情况。则下列叙述正确的是( )

A. A2、B2、AB均为气体,正反应放热
B. AB为气体,A2、B2中最少有一种为非气体,正反应放热
C. AB为气体,A2、B2中最少有一种为非气体,正反应吸热
D. AB为液体,A2、B2中最少有一种为非气体,正反应吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应的理论是一个经过简化的概念模型,合理简化的概念模型是研究化学反应原理的基础。反应速率的碰撞理论提出:能引发化学反应的碰撞称为有效碰撞。
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是________(填“a”“b”或“c”)。

(2)过渡态理论是在碰撞理论的基础上提出的:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。根据图Ⅱ写出相应的热化学方程式:_____________________________________________ 。
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了活化能从而改变了反应的途径。请在图Ⅱ中画出该反应在其他条件不变,仅使用催化剂而使反应速率加快的能量变化示意图。________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com