
| n |
| 2 |
| n |
| 2 |
| 3n |
| 2 |
| 3n |
| 2 |
| n |
| 2 |
| n |
| 2 |
| n |
| 2 |
| n |
| 2 |
| 3n |
| 2 |
| 3x |
| 2 |
| 3n |
| 2 |
| 3x |
| 2 |


科目:高中化学 来源: 题型:
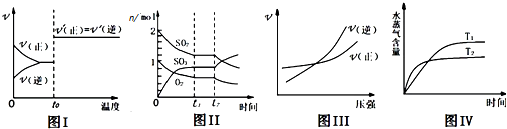
| A、图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
| B、图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
| C、图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
| D、图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
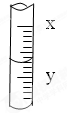
| A、4.30mL |
| B、4.6mL |
| C、4.3mL |
| D、4.60mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
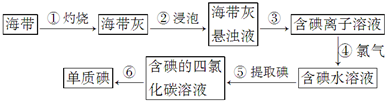
查看答案和解析>>
科目:高中化学 来源: 题型:
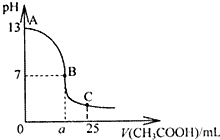 (1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择
(1)用已知浓度的NaOH溶液测定某H2SO4溶液的浓度.选择查看答案和解析>>
科目:高中化学 来源: 题型:
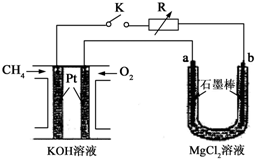 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源进行氯化镁溶液电解实验,电解装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X的能量一定高于M |
| B、因该反应为放热反应,故不必加热就可发生 |
| C、Y的能量一定高于N |
| D、X和Y的总能量一定高于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同一原子中一定没有能量相同的电子 |
| B、6C的电子排布式1s22s22px2违反了洪特规则 |
| C、电子排布式1s22s22p63s23p63d3违反了能量最低原理 |
| D、电子排布式1s22s22p63s23p10违反了泡利原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3- | ||||
| B、FeS固体放入稀硝酸溶液中:FeS+2H+=Fe2++H2S↑ | ||||
| C、(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ | ||||
D、用惰性电极电解氯化钠溶液:2Cl-+2H+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com