
【题目】用如图所示装置进行实验:
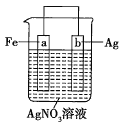
若图中x轴表示流入正极的电子的物质的量,则y轴可以表示:①![]() ,②
,②![]() ,③a棒的质量,④b棒的质量,⑤溶液的质量中的( )
,③a棒的质量,④b棒的质量,⑤溶液的质量中的( )
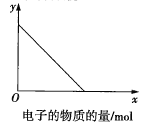
A.①③B.②④C.①③⑤D.②④⑤
科目:高中化学 来源: 题型:
【题目】下列反应对应的离子方程式正确的是
A.向Al2(SO4)3溶液中加入过量氨水:Al3++4OH-=![]() +2H2O
+2H2O
B.将Cl2通入FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-
C.将钠投入硫酸铜溶液中:2Na+Cu2+ =Cu+ 2Na+
D.向小苏打溶液中加入少量Ca(OH)2 溶液:Ca2++2OH-+![]() =CaCO3↓+2H2O+
=CaCO3↓+2H2O+ ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.升高温度,水的离子积增大
B.![]() 气体受压缩后,气体颜色先加深,后略变浅
气体受压缩后,气体颜色先加深,后略变浅
C.![]() ,
,![]() ,HIg的平衡体系,压缩容器体积,气体色变深
,HIg的平衡体系,压缩容器体积,气体色变深
D.![]() 中加入
中加入![]() 溶液,溶液颜色变浅
溶液,溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4 (s)![]() 2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3 (g)+ CO2 (g) 。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
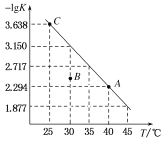
A.NH3的体积分数不变时,该反应一定达到平衡状态
B.该反应的△H>0
C.30 ℃时,B点对应状态的v(正)<v(逆)
D.C点对应状态的平衡常数K(C)=10-3.638
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为发光二极管连接柠檬电池装置,下列说法正确的是

A. 铁环作为柠檬电池的正极
B. 电子由发光二极管经导线流向Fe环
C. 负极的电极反应为:Fe-2 e-===Fe2+
D. 可将柠檬替换成盛装酒精溶液的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮元素及其化合物与生产、生活密切相关,回答下列问题。
(1)某有机物的结构简式如图。该有机物分子是___(填“极性”或“非极性”)分子,该有机物分子中电负性最大的原子为___。
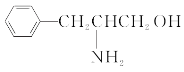
(2)乙二胺(H2NCH2CH2NH2)分子中氮原子杂化类型为___,乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高很多,原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B原子最外电子层的p能级处于半满状态,C原子最外层的p能级电子数是s能级电子数的2倍,C、F处于同一主族,E最外层电子数比最内层多1。回答下列问题:
(1)E元素基态原子的电子排布式为___。
(2)用电子排布图表示F元素原子的价电子排布:____。
(3)F、G元素对应的最高价含氧酸中酸性较强的是___(填化学式)。
(4)离子半径:D+___(填“<”“>”或“=”,下同)B3-,第一电离能:B___C,电负性:C__F。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比为1∶1,X的电子式为___。试写出Cu、稀硫酸与X反应制备硫酸铜的离子方程式:__。
(6)写出E的单质与D的最高价氧化物对应的水化物反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A. 水分子的比例模型![]()
B. 过氧化氢的电子式为:![]()
C. 石油的分馏和煤的气化、液化均为物理变化
D. 甲基环丁烷二氯代物的同分异构体的数目是10种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低
C.打开汽水瓶,有气泡从溶液中冒出
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com