
【题目】下列关于价层电子对互斥模型(VSEPR模型)和杂化轨道理论的叙述中正确的是
A. 凡是中心原子采取sp2杂化的分子,其分子构型都是平面三角形
B. 对于主族元素,中心原子的杂化轨道数等于价层电子对数
C. 杂化轨道可用于形成![]() 键、π键或用于容纳未参与成键的弧电子对
键、π键或用于容纳未参与成键的弧电子对
D. Sp3杂化轨道是由任意的1个s轨道和3个p轨道杂化形成的四个sp3杂化轨道
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是化肥工业和化工生产的主要原料,工业上合成氨使用的氢气主要来自合成气(CO、H2混合气体)。请回答下列问题:
(1)工业上合成氨的反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH 。 已知:
2NH3(g) ΔH 。 已知:
化学键 | H-H | N≡N | N-H |
键能/kJ·mol-1 | 436 | 945.6 | 391 |
化学键的键能是形成或断裂1 mol 化学键放出或吸收的能量,单位为kJ/mol。上述反应的ΔH________________。
(2)联氨(又称肼,N2H4),试写出联氨的电子式_________;联氨又可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g) ΔH1
N2H4(l)+O2(g)= N2(g)+2H2O(g) ΔH2
则N2(g)+2O2(g)=N2O4 (l) ΔH3=_________
(3)以氨气代替氢气来研发氨燃料电池是当前科研的一个热点。氨燃料电池使用的电解质溶液是KOH溶液,其装置如图所示。a电极反应式为________。若该燃料电池消耗标准状况下6.72 L空气(假设空气中O2体积分数为20%),则理论上消耗NH3的质量为_______g。

(4)甲醇燃料电池在生活应用也很广泛,在温度为650℃的熔融盐燃料电池中用甲醇、空气与CO2的混合气体作反应物,镍作电极,用Li2CO3和Na2CO3混合物作电解质。写出该电池的负极反应式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,
为原子序数依次增大的五种短周期元素,A是周期表原子半径最小的元素,![]() 同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
同周期且相邻,C的L层电子数是K层的3倍,E原子的核外电子数是B原子质子数的2倍。下列说法不正确的是( )
A.纯净的E元素的最高价氧化物可用于制造光导纤维
B.![]() 三种元素形成的化合物中一定只含共价键
三种元素形成的化合物中一定只含共价键
C.由元素![]() 组成的某种化合物可与
组成的某种化合物可与![]() 反应生成
反应生成![]()
D.元素A与![]() 形成的常见化合物中,热稳定性最好的是AD
形成的常见化合物中,热稳定性最好的是AD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定铁铜合金的组成,将15.2 g铁铜合金加入200 mL某浓度的稀硝酸中,待合金完全溶解,共生成NO气体4.48 L(标准状况下),并测得溶液中H+的物质的量浓度为0.5 mol·L-1,若反应前后溶液的体积变化忽略不计
(1)n(Fe)=_________n(Cu)=_________
(2)硝酸的物质的量浓度为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电池工作时,下列说法错误的

A. 甲池中N极的电极反应式为:O2+4e-+4H+=2H2O
B. 当N极消耗5.6L(标准状况下)O2时,铁极增重32g
C. 电子的流动方向为M→Fe→CuSO4溶液→Cu→N
D. M极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是___。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是______________。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+
(3)氧化铁是重要工业颜料,用废铁屑制备它的流程如下:
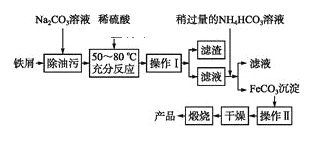
回答下列问题:
①操作Ⅰ的名称是____,操作Ⅱ的名称是____。②写出在空气中煅烧FeCO3的化学方程式________________。
(4)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定。
a.称取2.850 g绿矾(FeSO4·7H2O)产品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液放入锥形瓶中;
c.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①达到滴定终点时的现象____。
②某同学设计的下列滴定方式,最合理的是____。(夹持部分略去)(填字母序号)
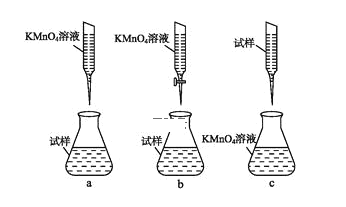
③计算上述样品中FeSO4·7H2O的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜合金以纯铜为基体加入一种或几种其他元素所构成的合金,是人类使用最早的金属材料。
(1)电解精炼铜的实验中使用的粗铜含有Cu和少量的Zn、Ag、Au、Cu2Te及其他化合物,请写出电解精炼铜时,阳极发生的电极反应式__________、______________。
(2)从粗铜精炼的阳极泥(主要含有Cu2Te)中提取粗碲的一种工艺流程如图:(已知TeO2是两性氧化物,微溶于水,易溶于强酸和强碱)
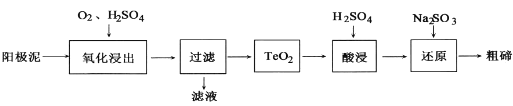
①“氧化浸出”时为使碲元素沉淀充分应控制溶液的pH为4.5~5.0,生成TeO2沉淀。如果H2SO4过量,溶液酸度过大,将导致碲沉淀不完全,原因是_____.
②“过滤”用到的玻璃仪器有____。
③“还原”时发生的离子方程式是________。
④判断粗碲洗净的方法是_________。
⑤在滤液中逐滴加入氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的透明溶液。写出此蓝色沉淀溶解的离子方程式_______。根据以上实验判断NH3和H2O与Cu2+的配位能力:NH3_____H2O(填“>”或“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是()
![]() 离子化合物含离子键,也可能含极性键或非极性键
离子化合物含离子键,也可能含极性键或非极性键
![]() 硫酸的酸性大于碳酸的酸性,所以非金属性
硫酸的酸性大于碳酸的酸性,所以非金属性![]()
![]() 含金属元素的化合物不一定是离子化合物
含金属元素的化合物不一定是离子化合物
![]() 由非金属元素组成的化合物一定是共价化合物
由非金属元素组成的化合物一定是共价化合物
![]() 熔融状态能导电的化合物是离子化合物
熔融状态能导电的化合物是离子化合物
![]() 由分子组成的物质中一定存在共价键
由分子组成的物质中一定存在共价键
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com