
【题目】下列关于实验室保存药品的方法,错误的是( )
A.过氧化钠密封保存在细口玻璃瓶中
B.氯水保存在带磨口玻璃塞的棕色试剂瓶中
C.硫酸亚铁溶液在保存时应加入铁粉
D.金属钠保存在液体石蜡或煤油中
科目:高中化学 来源: 题型:
【题目】若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A. b=a-n-mB. 离子半径Am+<Bn-
C. 原子半径A<BD. A的原子序数比B大(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,取浓度相同的NaOH和HCl溶液,以3:2体积比相混合,所得溶液的pH等于12,则原溶液的浓度为
A. 0.01 mol·L-1 B. 0.017 mol·L-1
C. 0.05 mol·L-1 D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒研究提出的苯分子结构模型如图所示:
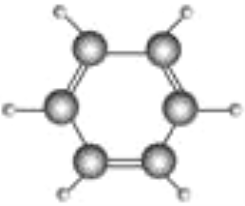
(1)请根据苯的分子结构模型,写出苯的分子式__________________结构式____________,结构简式________________。
(2)书写苯和溴发生取代反应的方程式(Fe或者FeBr3作催化剂)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物在生产、生活中应用广泛。
Ⅰ.(1)镁在元素周期表中的位置为___________
(2)镁的碳化物常见的有MgC2和Mg2C3两种,可分别发生水解反应生成乙炔和丙二烯,写出MgC2水解反应的方程式为_________;Mg2C3的电子式为_________.
(3)由Mg可制成“镁一次氯酸盐”燃料电池,其装置示意图如下图所示,该电池反应的离子方程式为____________.
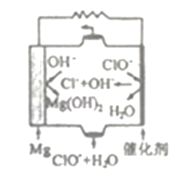
Ⅱ.利用氯碱工业盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下图所示。
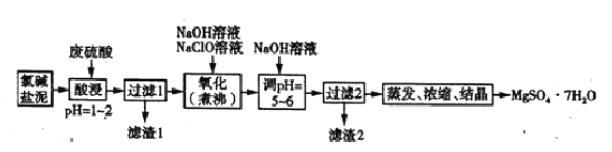
(4)酸浸时,FeCO3与硫酸反应的化学方程式为_____________,为了提高浸取率可采取的措施有_____(填字母)。
a.多次用废硫酸浸取 b.减小盐泥粒度并充分搅拌 c.适当延长浸取时间
(5)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子程式为______________;滤渣2为MnO2和_____________、___________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,青蒿素为无色针状晶体,难溶于水,易容有机溶剂,熔点为156-157℃。青蒿素是一种有效的抗疟药,某化学兴趣小组对青蒿素的提取和组成进行如下的探究。
Ⅰ.提取青高素的方法之一是乙醚浸取法,提取流程如下:
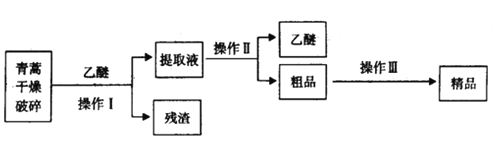
(1)对青蒿进行破碎的目的是___________
(2)操作Ⅰ用到的玻璃仪器是__________,操作Ⅱ的名称是__________
Ⅱ.燃烧法测定青蒿素的最简式:
利用下列实验装置,将28.2g青蒿素放在燃烧管C中充分燃绕,测出生成的CO2和H2O的质量后,计算得出青蒿素的最简式。
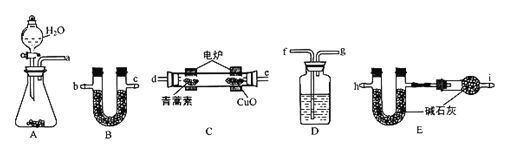
主要实验步骤如下:
①组装仪器,并检查装置的气密性。
②先将A装置的药品反应一会后,再将C装置通电反应。
③称量有关装置的实验前后的质量。
请回答下列问题:
(3)仪器各接口的连接顺序从左到右依次为_____(每个装置限用一次)。
(4)①装置B中的试剂为________,其作用是__________。
②装置C中CuO的作用是__________。
③装置D中的试剂为______,其作用是________________。
④装置E中的试剂为______,其作用是________________。
⑤装置F中的试剂为______,其作用是_________________。
(5)已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验,测量数据如表:
装置质量 | 实验前/g | 实验后/g |
B | 22.6 | 42.4 |
E | 80.2 | 146.2 |
则青蒿素的最简式为_____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2O4(g)![]() 2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
2NO2(g),将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) + 7O2 (g)= 6CO(g) + 8H2O(l) △H1=-2741.8 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) △H2 =-566 kJ/mol
(1) 反应C3H8(g) + 5O2(g)= 3CO2(g) + 4H2O (1) 的△H=_______。
(2) 现有lmol C3H8 在不足量的氧气里燃烧,生成1mol CO 和2mol CO2 以及气态水,将所有的产物通入一个固定体积为1L 的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+ H2O (g) ![]() CO2(g)+H2(g) △H= +4 1.2 kJ/mol
CO2(g)+H2(g) △H= +4 1.2 kJ/mol
①下列事实能说明该反应达到平衡的是______
a.体系中的压强不发生变化
b.v正(H2) = v逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min 后体系达到平衡,经测定,H2 为0.8mol,则平衡常数K=_______。
③其他条件不变,向平衡体系中充入少量CO 则平衡常数_____ (填增大、减小或不变)。
(3) 依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-由______极移向______ 极(填“正”或“负”);电池的负极电极反应式为____________。
(4) 用上述燃料电池和惰性电极电解足量Mg(NO3)2 和NaCl 的混合溶液。电解开始后阴极的现象为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化银在水中的溶解平衡为: AgCl(s)Ag+(aq)+Cl﹣(aq),
25℃,其Ksp为:Ksp=[Ag+][Cl﹣]=1.8×10﹣10 mol2L﹣2 . 现把氯化银(足量)分别放人:
①100mL蒸馏水中;
②100mL 0.1molL﹣1的盐酸溶液中;
③1000mL 0.1molL﹣l的氯化铝溶液中;
④100mL0.1molL﹣1的氯化镁溶液中.
充分搅拌后,相同温度下,银离子浓度由大到小的顺序是(用序号回答) . 在0.1molL﹣l氯化铝溶液中,银离子的物质的量浓度最大可达到 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com