
【题目】丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) + 7O2 (g)= 6CO(g) + 8H2O(l) △H1=-2741.8 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) △H2 =-566 kJ/mol
(1) 反应C3H8(g) + 5O2(g)= 3CO2(g) + 4H2O (1) 的△H=_______。
(2) 现有lmol C3H8 在不足量的氧气里燃烧,生成1mol CO 和2mol CO2 以及气态水,将所有的产物通入一个固定体积为1L 的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+ H2O (g) ![]() CO2(g)+H2(g) △H= +4 1.2 kJ/mol
CO2(g)+H2(g) △H= +4 1.2 kJ/mol
①下列事实能说明该反应达到平衡的是______
a.体系中的压强不发生变化
b.v正(H2) = v逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②5min 后体系达到平衡,经测定,H2 为0.8mol,则平衡常数K=_______。
③其他条件不变,向平衡体系中充入少量CO 则平衡常数_____ (填增大、减小或不变)。
(3) 依据(1)中的反应可以设计一种新型燃料电池,一极通入空气,另一极通入丙烷气体;燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-由______极移向______ 极(填“正”或“负”);电池的负极电极反应式为____________。
(4) 用上述燃料电池和惰性电极电解足量Mg(NO3)2 和NaCl 的混合溶液。电解开始后阴极的现象为____________________________。
【答案】 -2219.9 kJ/mol bd 3.5 不变 正 负 C3H8+10O2- -20e-=3CO2↑+4H2O 有大量无色气泡(或气体)产生,并且有白色沉淀产生
【解析】(1)利用盖斯定律,根据所求的热化学方程式,[①+②×3]/2即得C3H8(g)+5O2(g)=3CO2(g) +4H2O(1),所以△H=[-2741.8kJ/mol+(-566kJ/mol)×3]/2= -2219.9kJ/mol;
(2)①已知化学平衡CO(g)+H2O(g)![]() CO2(g)+H2(g)是一个反应前后气体体积不变的吸热反应,反应过程中压强始终不变,故a错误;当正逆反应速率相等时,反应已达平衡,故b正确;混合气体的平均相对分子质量由M=m/n可得,M始终不变,故c错误;各组分的浓度不再变化,说明反应已达平衡,故d正确。正确答案为bd;
CO2(g)+H2(g)是一个反应前后气体体积不变的吸热反应,反应过程中压强始终不变,故a错误;当正逆反应速率相等时,反应已达平衡,故b正确;混合气体的平均相对分子质量由M=m/n可得,M始终不变,故c错误;各组分的浓度不再变化,说明反应已达平衡,故d正确。正确答案为bd;
②已知反应起始时c(CO)=1mol/L,c(H2O)=4mol/L,c(CO2)=2mol/L,c(H2)=0,达到平衡时c(H2)=0.8mol/L,则c(CO2)=2.8mol/L,c(CO)=0.2mol/L,c(H2O)=3.2mol/L,因此K=![]() =
= ![]() =3.5;
=3.5;
③由于平衡常数只与温度有关,所以在温度不变时再充入少量CO,平衡常数是不变的;
(3)根据原电池的工作原理,电池内部电解质中的阴离子由正极向负极移动,其中通空气的一极为正极,通丙烷的一极为负极,则正极反应式为O2+4e-=2O2-,而负极反应式为C3H8+10O2- -20e-=3CO2↑+4H2O;
(4)用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,阴极附件溶液中的阳离子放电能力强的是H+,2H++2e-=H2,而阳极附近溶液中的阴离子放电能力强的是Cl-,2Cl—2e-=Cl2,同时在阴极附近的溶液中生成的OH-与Mg2+结合生成Mg(OH)2沉淀,所以电解开始后,阴极的现象是有大量无色气泡(或气体)和白色沉淀产生。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A.20 mL 2 mol/L FeCl3溶液
B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液
D.40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于实验室保存药品的方法,错误的是( )
A.过氧化钠密封保存在细口玻璃瓶中
B.氯水保存在带磨口玻璃塞的棕色试剂瓶中
C.硫酸亚铁溶液在保存时应加入铁粉
D.金属钠保存在液体石蜡或煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止番茄在长途运输过程中发生腐烂,常常运输尚未完全成熟的果实,运到目的地后再用一种植物生长调节剂将其催熟。这种植物生长调节剂是下列物质中的
A. 乙烷 B. 乙烯 C. 苯 D. 酒精
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O,他们设计如下实验制取氯气并验证其性质。请回答下列问题:
2CaSO4+2Cl2↑+2H2O,他们设计如下实验制取氯气并验证其性质。请回答下列问题:
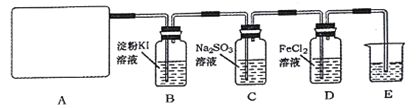
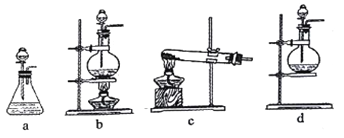
(1)该实验中A部分的装置是___ (填写装置的序号)。
(2)装置B中的现象是_________。
(3)请写出装置D中反应的离子方程式_________,装置E的作用是_______。
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):______。
(5)制取Cl2的方法有多种,请再写出一种制备方法,____________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu与Zn用导线连接后浸入稀硫酸组成原电池装置。下列说法正确的是
A. 锌为负极,铜为正极
B. 铜片溶解,锌片上产生气体
C. 电子由铜极流出经导线流向锌极
D. 溶液中SO42-定向移向铜极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“抗击新冠肺炎疫情,人人都有群防责任”,下列做法符合科学道理的是()
A.出门不佩戴口罩B.家庭消毒时,消毒液越浓越好
C.保持室内清洁卫生和通风D.大量喝酒可以预防“新型冠状病毒”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的微量元素的说法不正确的是( )
A. Cu、Zn、Mo等是细胞内的微量元素
B. 生物体中可以有、也可以没有的一些元素
C. 微量元素是维持正常生命活动不可缺少的元素
D. 指生物生活所必需的,但需要量却很少的一些元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若已知反应 NaNO2+HF═HNO2+NaF,7.2×10﹣4、4.6×10﹣4分别是上式所涉及的两种酸的电离常数.由此可判断下列叙述中不正确的是( )
A.K(HF)=c(F﹣)c(H+)/c(HF )
B.K(HNO2)=7.2×10﹣4
C.酸性强弱为 HF>HNO2
D.K(HNO2)<K(HF)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com