
【题目】肼(N2H4)又称联氨,常用作火箭推进器的燃料。已知:
①N2(g)+O2(g)=2NO(g) ΔH1=+182kJ·mol-1;
②2NO(g) +O2(g)=2NO2(g) ΔH2=-114.3kJ·mol-1;
③2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH2=-1135.7kJ·mol-1。
下列说法正确的是( )
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-1068kJ·mol-1
B.用铂作电极,以KOH溶液为电解液的肼![]() 空气燃料电池,放电时的负极反应为N2H4-4e-+4OH-=N2+4H2O
空气燃料电池,放电时的负极反应为N2H4-4e-+4OH-=N2+4H2O
C.肼与氨类似,溶于水显碱性,可表示为N2H4+H2O=N2H5++OH-
D.某密闭容器中存在:2NO2(g)![]() N2O4(g),加压
N2O4(g),加压![]() 缩小体积
缩小体积![]() 后颜色先变深后变浅,不能用勒夏特列原理解释
后颜色先变深后变浅,不能用勒夏特列原理解释
【答案】B
【解析】
A.①N2(g)+O2(g)=2NO(g) ΔH1=+182kJ·mol-1;②2NO(g) +O2(g)=2NO2(g) ΔH2=-114.3kJ·mol-1;③2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH2=-1135.7kJ·mol-1,根据盖斯定律,将![]() 得:N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH1=-534kJ·mol-1,故A错误;
得:N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH1=-534kJ·mol-1,故A错误;
B.该燃料电池中,负极上肼失电子发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2+4H2O,故B正确;
C.肼是与氨类似的弱碱,它易溶于水,N2H4H2O存在电离平衡,电离出N2H5+、OH-,电离方程式为N2H4+H2ON2H5++OH-,故C错误;
D.加压时容器体积减小,二氧化氮浓度增大,气体颜色加深,平衡正向移动,气体颜色又变浅,能用平衡移动原理解释,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】40 ℃时,在氨—水体系中不断通入![]() ,各种离子的变化趋势如图所示。下列说法不正确的是( )
,各种离子的变化趋势如图所示。下列说法不正确的是( )
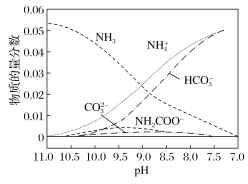
A.在![]() 时,
时,![]()
B.不同pH的溶液中存在关系:![]()
C.随着![]() 的通入,
的通入,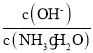 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含![]() 的中间产物生成
的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠![]() 在溶液中会生成
在溶液中会生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都是具有漂白作用。已知
都是具有漂白作用。已知![]() ,经测定
,经测定![]() 时各组分含量随pOH变化情况如图所示
时各组分含量随pOH变化情况如图所示![]() 没有画出
没有画出![]() ,此温度下,下列分析正确的是
,此温度下,下列分析正确的是![]()
A.![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
B.![]() 时,
时,![]() 部分转化成
部分转化成![]() 和
和![]() 离子的方程式为:
离子的方程式为:![]()
C.![]() 时,溶液中含氯微粒的浓度大小为:
时,溶液中含氯微粒的浓度大小为:![]()
D.同浓度的![]() 溶液和
溶液和![]() 溶液等体积混合,则混合溶液中有:
溶液等体积混合,则混合溶液中有:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
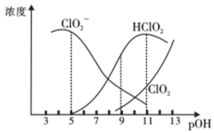
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料,该电池工作原理如图。下列说法正确的是( )
A.a为C4H10,b为CO2
B.在熔融电解质中,CO32-向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为C4H10-26e-+13CO32-=17CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
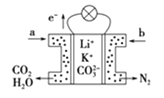
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6·SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A.X与电池的Li电极相连
B.电解过程中c(BaC12)保持不变
C.该锂离子电池正极反应为:FeS+2Li++2e =Fe +Li2S
D.若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国尿素合成塔(尿塔)使用寿命仅为欧美国家的1/4。为此北京钢铁研究院对某尿塔腐蚀过程进行研究,得出下列腐蚀机理:
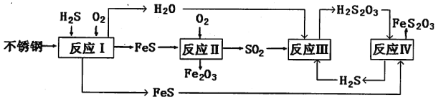
(1)H2S来自合成尿素的天然气。在380K、体积为2L的密闭容器中,存在反应:H2(g)+S(s)![]() H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
H2S(g) △H=+21.6 kJ·mol-1。反应达到平衡时,H2、S、H2S的物质的量均为3 mol。
①380K时该反应的化学平衡常数为__________。
②下列对该反应分析正确的是_________(填序号)。
(2)反应II的化学方程式为:____________________________________。
(3)已知室温下H2S2O3:K1=2.2×10-1,K2=2.5×10-2。
①Na2S2O3水溶液中电荷守恒式为___________________________;
②反应IV的化学方程式_____________________________________。该反应_________(填“能”或“不能”)说明FeS溶解性强于FeS2O3。
(4)此尿塔的最终腐蚀产物为__________________。为了有效防腐,北钢建议该尿塔在生产中用CuSO4溶液“脱硫(H2S)”,离子反应方程式为_________。(室温下,H2S:K1=1.3×10-7、K2=7.1×10-15。CuS:Ksp=6.3×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是主要大气污染物之一,工业上可用如下装置吸收转化SO2(A、B为惰性电极)。下列说法正确的是
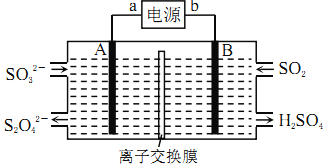
A. 电子流动方向为:B→b→a→A
B. a、A极上均发生氧化反应
C. 离子交换膜为阳离子交换膜
D. B极上的电极反应式为:SO2+2eˉ+2H2O=SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计了下图所示的电化学装置,电极I为锌,其他电极均为石墨,盐桥是浸泡了饱和氯化钾溶液的琼脂,丙池是滴加了酚酞的氯化钠溶液。下列叙述正确的是( )

A.电子由电极IV通过外电路流向电极I
B.装置工作过程中III电极周围出现红色
C.电极II发生还原反应
D.盐桥中Cl-向乙池移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铝片(未打磨)与Na2CO3溶液的反应,实验如下:
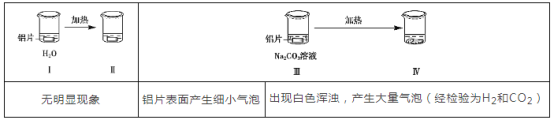
下列说法不正确的是( )
A. Na2CO3溶液中存在水解平衡:CO32-+H2O![]() HCO3-+OH-
HCO3-+OH-
B. 对比Ⅰ、Ⅲ,推测Na2CO3溶液能破坏铝表面的氧化膜
C. Ⅳ溶液中可能存在大量Al3+
D. 推测出现白色浑浊的可能原因:AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com