
【题目】40 ℃时,在氨—水体系中不断通入![]() ,各种离子的变化趋势如图所示。下列说法不正确的是( )
,各种离子的变化趋势如图所示。下列说法不正确的是( )
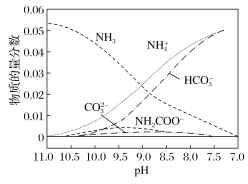
A.在![]() 时,
时,![]()
B.不同pH的溶液中存在关系:![]()
C.随着![]() 的通入,
的通入,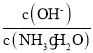 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含![]() 的中间产物生成
的中间产物生成
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】二氧化氯是高效、低毒的消毒剂。已知:ClO2是极易溶于水的气体,实验室制备及性质探究装置如图所示。回答下列问题:
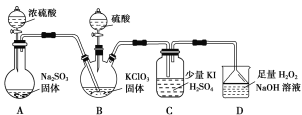
(1)装置B用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为___________。装置C中滴有几滴淀粉溶液,反应时有蓝色岀现。淀粉的作用是______。
(2)装置C的导管靠近而不接触液面,其目的是________。
(3)用ClO2消毒自来水,其效果是同质量氯气的______倍(保留一位小数)。
(4)装置D用于吸收尾气,若反应的氧化产物是一种单质,且氧化剂与氧化产物的物质的量之比是2∶1,则还原产物的化学式是___________。
(5)若将装置C中的溶液改为Na2S溶液,通入ClO2后溶液无明显现象。由此可以产生两种假设:
假设a:ClO2与Na2S不反应。
假设b:ClO2与Na2S反应。
①你认为哪种假设正确,阐述原因:___________。
②请设计实验证明你的假设(仅用离子方程式表示):__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代化学测定有机物组成及结构的分析方法较多。下列有关说法正确的是
A.元素分析仪不仅可以测出试样常见的组成元素及含量,还可以测定其分子的空间结构
B.![]()
C.通过红外线光谱图分析可以区分乙醇和乙酸乙酯
D.质谱法和紫外光谱法不属于测定有机物组成和结构的现代分析方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4 溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6mol/LH2C2O4溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 2.0 | 1.0 | 6.4 |

(1)根据上表中的实验数据,可以得到的结论是_______。
(2)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据2所示信息提出了新的假设,并继续进行实验探究。
①该小组同学提出的假设是_______。
②请你帮助该小组同学完成实验方案,并填写表中空白。
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 再向试管中加入少量固体X | 室温下溶液颜 色褪至无色所需时间/min | |||
0.6mol/LH2C2O4 溶液 | H2O | 0.2mol/LKMnO4溶液 | 3mol/L稀硫酸 | |||
4 | 3.0 | 2.0 | 2.0 | 3.0 | t | |
固体X是_______。
③若该小组同学提出的假设成立,时间t_______4.0min(填>、=或<)。
(3)为探究温度对化学反应速率的影响,该小组同学准备在上述实验基础上继续进行实验,请你帮助该小组同学完成该实验方案设计_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为:![]()
![]()
![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 充电时,阴极质量减小且Na+数目增加
B. 充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
C. 放电时,Na+向正极移动
D. 放电时,负极的电极反应式为NamCn-me-=mNa++Cn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图(不考虑电极产物的溶解),则下列说法正确的是( )
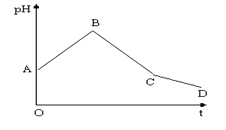
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种高效消毒剂,可用如下反应制得:2NaClO3+Na2SO3+H2SO4![]() 2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
2ClO2↑+2Na2SO4+H2O,下列说法正确的是( )
A. 该反应属于复分解反应
B. NaClO3被还原,发生还原反应
C. 反应中Na2SO3作氧化剂
D. 生成6.75 g ClO2时,转移0.2 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
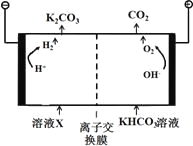
(1)在阳极区发生的反应包括_____________和H ++ HCO3-=H2O + CO2↑。
(2)简述CO32-在阴极区再生的原理_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,常用作火箭推进器的燃料。已知:
①N2(g)+O2(g)=2NO(g) ΔH1=+182kJ·mol-1;
②2NO(g) +O2(g)=2NO2(g) ΔH2=-114.3kJ·mol-1;
③2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH2=-1135.7kJ·mol-1。
下列说法正确的是( )
A.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH1=-1068kJ·mol-1
B.用铂作电极,以KOH溶液为电解液的肼![]() 空气燃料电池,放电时的负极反应为N2H4-4e-+4OH-=N2+4H2O
空气燃料电池,放电时的负极反应为N2H4-4e-+4OH-=N2+4H2O
C.肼与氨类似,溶于水显碱性,可表示为N2H4+H2O=N2H5++OH-
D.某密闭容器中存在:2NO2(g)![]() N2O4(g),加压
N2O4(g),加压![]() 缩小体积
缩小体积![]() 后颜色先变深后变浅,不能用勒夏特列原理解释
后颜色先变深后变浅,不能用勒夏特列原理解释
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com