
【题目】钠离子电池具有成本低、能量转换效率高、寿命长等优点。一种钠离子电池用碳基材料(NamCn)作负极,利用钠离子在正负极之间嵌脱过程实现充放电,该钠离子电池的工作原理为:![]()
![]()
![]() 。下列说法不正确的是( )
。下列说法不正确的是( )
A. 充电时,阴极质量减小且Na+数目增加
B. 充电时,阳极的电极反应式为NaCoO2-me-=Na1-mCoO2+mNa+
C. 放电时,Na+向正极移动
D. 放电时,负极的电极反应式为NamCn-me-=mNa++Cn
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
(1)用_______式滴定管盛装c mol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是____________ 如图表示某次滴定时50 mL滴定管中前后液面的位置。滴定管读数时应注意____________________________________。尖嘴部分应____________________________。用去的标准盐酸的体积是_____________mL

(2)该实验应选用_____作指示剂;操作中如何确定终点?______________________________。
(3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________;
b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列化合物的名称或结构简式:
(1)结构简式为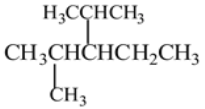 的烃可命名为:________________________________。
的烃可命名为:________________________________。
(2)结构简式为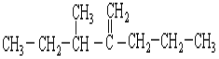 此烃名称为____________________________。
此烃名称为____________________________。
(3)2,5-二甲基-2,4-己二烯 的结构简式:__________________________。
(4)有机物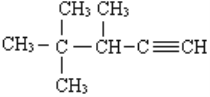 的系统名称为________________
的系统名称为________________
(5)结构简式  的烃可命名为___________________。
的烃可命名为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、
、![]() 、
、![]() 为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,![]() 为地壳中含量最高的过渡金属元素,
为地壳中含量最高的过渡金属元素,![]() 与
与![]() 同主族,
同主族,![]() 与
与![]() 同周期,且
同周期,且![]() 与
与![]() 的原子序数之和为20,
的原子序数之和为20,![]() 单质能与无色无味液体
单质能与无色无味液体![]() 反应置换出
反应置换出![]() 单质,
单质,![]() 单质也能与
单质也能与![]() 反应置换出
反应置换出![]() 单质,
单质,![]() 、
、![]() 、
、![]() 均能与
均能与![]() 形成离子化合物,下列说法不正确的是( )
形成离子化合物,下列说法不正确的是( )
A. ![]() 、
、![]() 两元素的形成的化合物都为黑色固体
两元素的形成的化合物都为黑色固体
B. ![]() 、
、![]() 形成的离子化合物可能含有其价键
形成的离子化合物可能含有其价键
C. ![]() 的单质只有还原性,没有氧化性
的单质只有还原性,没有氧化性
D. 工业上可以用铝热法制取金属![]() 用于野外焊接铁轨
用于野外焊接铁轨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S是一种二元弱酸,回答以下问题:
(1)0.1mol/L NaHS溶液显碱性,则c(S2-)___________c(H2S)(填“大于” ,“小于” 或“等于” ) 。
(2)已知常温下,CaS饱和溶液中存在平衡:CaS(s)![]() Ca2+(aq)+S2-(aq) ΔH>0。
Ca2+(aq)+S2-(aq) ΔH>0。
①温度升高时,Ksp________ (填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)________,原因是__________________________________(用文字和离子方程式说明)。
(3)若向CaS悬浊液中加入Cu(NO3)2溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40 ℃时,在氨—水体系中不断通入![]() ,各种离子的变化趋势如图所示。下列说法不正确的是( )
,各种离子的变化趋势如图所示。下列说法不正确的是( )
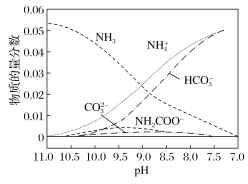
A.在![]() 时,
时,![]()
B.不同pH的溶液中存在关系:![]()
C.随着![]() 的通入,
的通入,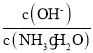 不断增大
不断增大
D.在溶液中pH不断降低的过程中,有含![]() 的中间产物生成
的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1mol/L氨水中逐滴加入0.1mol/L盐酸,测得溶液的pH随加入盐酸的体积变化如图所示。下列说法正确的是( )
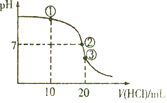
A.①溶液中:c(Cl-)=2c(NH4+)+2c(NH3·H2O)
B.②溶液中:c(NH4+)= c(Cl-)= c(OH-)= c(H+)
C.③溶液中:c(H+)= c(OH-)+ c(NH4+)+c(NH3·H2O)
D.滴定过程中可能出现:c(NH3·H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液中的行为是中学化学的重要内容,按要求回答下列问题.
(1)在醋酸水溶液中存在平衡CH3COOH![]() CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
CH3COO-+H+若分别改变下列条件:①加水稀释②加热③加少量固体醋酸钠,其中能使醋酸电离程度增大的是_______,能使溶液pH增大的是_______(填序号)。
(2)常温下,0.1mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:________________________________。
(3)AlCl3溶液加热蒸干并灼烧最终得到物质是________(填化学式),将NaHCO3与Al2(SO4)3溶液混合后可做泡沫灭火剂,其原理是_______(用离子方程式表示)。
(4)已知下列物质在20℃下的Ksp如下:
化学式 | AgCl | AgBr | AgI |
颜色 | 白色 | 浅黄色 | 黄色 |
Ksp | 2.0×10-10 | 5.4×10-13 | 8.3×10-17 |
①当向含相同浓度Cl-、Br-、I-的溶液中滴加AgNO3溶液时,_______先沉淀(填离子符号),
②向BaCl2溶液中加入AgNO3和KBr,当两种淀共存时,  =__________。
=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6·SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。

下列分析正确的是
A.X与电池的Li电极相连
B.电解过程中c(BaC12)保持不变
C.该锂离子电池正极反应为:FeS+2Li++2e =Fe +Li2S
D.若去掉阳离子膜将左右两室合并,则X电极的反应不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com