
设阿伏加德罗常数(NA)的数值为nA,下列说法正确的是( )
A.1 mol Cl2与足量Fe反应,转移的电子数为3nA
B.1.5 mol NO2与足量H2O反应,转移的电子数为nA
C.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3nA
D.0.10 mol Fe粉与足量水蒸气反应生成的H2分子数为0.10nA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
Fe(OH)3+3H+=Fe2++3H2O
硫铁矿烧渣(主要成分为 Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下:

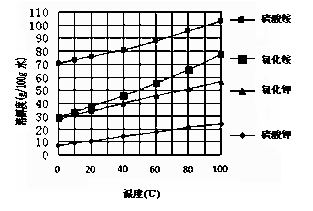 已知几种盐的溶解度随温度变化的
已知几种盐的溶解度随温度变化的
曲线如右图所示:
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子
是______________。
(2)煅烧 FeCO3生成产品 I的化学反应
方程式为 _______。实验室进行煅烧操作所
需仪器除了酒精喷灯、泥三角、三脚架、玻
璃棒外,还有__________。
(3)产品Ⅱ的化学式为 _______________,为了获得产品Ⅱ,向 (NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 。
(4)检验产品 II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, 。
查看答案和解析>>
科目:高中化学 来源: 题型:
BaCl2·xH2O中结晶水数目可通过重量法来确定:
①称取1.222g样品,置于小烧杯中,加入适量稀盐酸,加热溶解,边搅拌边滴加稀硫酸到沉淀完全,静置;
② 过滤并洗涤沉淀;
过滤并洗涤沉淀;
③将盛有沉淀的滤纸包烘干并中温灼烧;转入高温炉中,反复灼烧到恒重,称得沉淀质量为1.165g。
回答下列问题:
(1)在操作②中,需要先后用稀硫酸和 洗涤沉淀;检验沉淀中氯离子是否洗净的方法是 。
(2)计算BaCl2·xH2O中的x= (要求写出计算过程)。
(3)操作③中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,这使x的测定结果 (填“偏低”、“偏高”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列叙述正确的是
A.等物质的量的N2和CO所含分子数均为NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA
D.标准状况下,2.24L戊烷所含分子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设nA代表阿伏加德罗常数(NA)的数值,下列说法正确的是( )
A.1 mol硫酸钾中阴离子所带电荷数为nA
B.乙烯和环丙烷(C3H6)组成的28 g混合气体中含有3nA个氢原子
C.标准状况下,22.4 L氯气与足量氢氧化钠溶液反 应转移的电子数为nA
应转移的电子数为nA
D.将0.1 mol氯化铁溶于1 L水中,所得溶液含有0.1nA个Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA
B.标准状况下,22.4L己烷中共价键数目为19NA
C.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个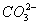
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A. 一定温度、压强下,气体体积由其分子的大小决定
B. 一定温度、压强下,气体体积由其物质的量的多少决定
C. 气体摩尔体积是指1mol任何气体所占的体积为22.4L
D.不同的气体,若体积不等,则它们所含的分子数一定不等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中指定粒子的 数目大于6.02×1023的是( )
数目大于6.02×1023的是( )
A.2 g重水(D2O,D为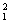 H)中含有的中子数
H)中含有的中子数
B.0.1 mol F-中含有的电子数
C.标准状况下11.2 L N2和NO混合气体中的原子数
D.1 L 1 mol·L-1Na2SO4溶液中的Na+离子数
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W有如图所示的转化关系,则X、W可能是

①C、O2 ②AlCl3、NaOH ③Fe、HNO3 ④S、O2
A.①②③ B.①② C.③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com