
����Ŀ�������Ҳ��Ħ����������Ϊƽ��Ħ�����������ţ�![]() �������¹���
�������¹���![]() ���㷨�������
���㷨�������
A. ij��������ڱ�״�����ܶȦ�=1.429g/L����û�������![]() =32g/mol
=32g/mol
B. ��֪ijCO��CO2��ɵĻ�������![]() =30g/mol����CO��CO2�������Ϊ7:1
=30g/mol����CO��CO2�������Ϊ7:1
C. ��֪��Ӧ��(NH4)2CO3 ![]() 2NH3�� + H2O�� + CO2����һ������(NH4)2CO3������ȫ�ֽ�����û�����壨�¶�200��C�£���
2NH3�� + H2O�� + CO2����һ������(NH4)2CO3������ȫ�ֽ�����û�����壨�¶�200��C�£���![]() =26.3g/mol
=26.3g/mol
D. һ���¶Ⱥ�ѹǿ�£��������ܶ��������ܶȵ�14.3�������ʱ����![]() =28.6g/mol
=28.6g/mol
���𰸡�C
��������
A. ij��������ڱ�״�����ܶ���=1.429g/L�����ڱ���������Ħ�������22.4L/mol����˸û�������ƽ��Ħ������Ϊ1.429g/L��22.4L/mol��32g/mol��A��ȷ��
B. ��֪ijCO��CO2��ɵĻ�������ƽ��Ħ������Ϊ30g/mol�������ʮ�ֽ��淨��֪CO��CO2�������Ϊ![]() ��7:1��B��ȷ��
��7:1��B��ȷ��
C. ���ݷ�Ӧ(NH4)2CO3 ![]() 2NH3��+H2O��+CO2����֪���跴Ӧ����1mol����(NH4)2CO3������ȫ�ֽ�����û�����壨�¶�200���£���ƽ��Ħ������Ϊ
2NH3��+H2O��+CO2����֪���跴Ӧ����1mol����(NH4)2CO3������ȫ�ֽ�����û�����壨�¶�200���£���ƽ��Ħ������Ϊ![]() ��24g/mol��C����
��24g/mol��C����
D. һ���¶Ⱥ�ѹǿ�£��������ܶ��������ܶȵ�14.3��������ݰ����ӵ����ɿ�֪��ʱ������ƽ��Ħ������Ϊ14.3��2g/mol��28.6g/mol��D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A2+B2��2AB�ķ�Ӧ���̿��Կ������£���H��ʾ�ù��̵������仯����
��A2��A+A ��H1
��B2��B+B ��H2
��A+B��AB ��H3
������˵������ȷ����
A. ����H3+����H1+��H2����0ʱ���÷�Ӧ�����ȷ�Ӧ
B. ��2��H3+����H1+��H2����0ʱ���÷�Ӧ�Ƿ��ȷ�Ӧ
C. ��2��H3+����H1+��H2����0ʱ���÷�Ӧ�Ƿ��ȷ�Ӧ
D. ����H3+����H1+��H2����0ʱ���÷�Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ܱ������У��м���һ�������ɻ����ĸ��壬�������ֳ������֡�����߳���1molN2���ұ߳���8gCO��CO2�Ļ������ʱ�����崦������ͼ��ʾλ�ã�V����V��=4��1(�����¶ȡ�ѹǿ����ͬ)������������CO��CO2�����ʵ�����Ϊ( )

A. 1��1 B. 1��3 C. 3��1 D. 2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ�����dz��õĸ������������Ҫ�ɽ�Ũ������ɲ�ͬŨ�ȵ�ϡ���ᡣ�ش��������⣺
��1��1L 0.5mol/L��H2SO4��Һ�к���H2SO4 __________g������H+___________��������뷽��ʽΪ__________________��������Һ����������Ƭ��Ӧ�����ɵ������ڱ�״�������Ϊ__________L����Ӧ�����ӷ���ʽΪ_______________________��
��2����������ϡ������Ҫ��ȡ��������Ϊ98%���ܶ�Ϊ1.84g/cm3��Ũ����_______mL���������һλС���������ƴ���Һ��Ҫ�IJ������������ձ�������������ͷ�ι����Ҫ__________��
��3��ϡ��Ũ����IJ�����__________________________________________________��
��4�����в���ʹ���Ƶ�������Һ�����ʵ���Ũ��ƫС����_______________��
A��ϡ��Ũ����ʱ��Һ�彦��
B������ƿ������������ˮ����
C��Ũ����ϡ�ͺ���Һû����ȴ�����¾�ת��
D��������ƿ��ˮ����ʱ���ӿ̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(C6H5-SH)��һ����;�㷺���л��ϳ��м��塣��ҵ���ó����ȱ�(C6H5-Cl)������(H2S)��Ӧ���Ʊ�����ӣ������и����ﱽ(C6H6) ���ɡ�
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) ��H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) ��H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) ��H2
S8(g) ��H2
��ӦII���ʱ䲻�ײ������ֲ������������:
��: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) ��H3=-29.0 kJ/mol
S8(g) ��H3=-29.0 kJ/mol
��ش�:
(1)��ӦIIΪ�����淴Ӧ�����������______________��
(2)�ֽ�һ�������ȱ�����������һ�̶��ݻ���������ģ�ҵ�������̣��ڲ�ͬ�¶��¾���Ӧ20���Ӳⶨ�������Ũ�ȣ��õ�ͼ1��ͼ2��
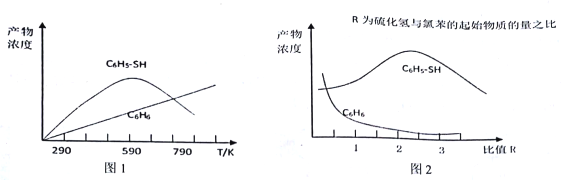
������˵������ȷ����____________��
A.��ͼ1��֪����ͬ�����·�ӦI�Ļ���Ӱٷ������ڷ�ӦII �Ļ���Ӱٷ���
B.ͼ1��C6H5-SH ��Ũ����590�����¶ȱ仯��ԭ������Ƿ�ӦII �����ķ�Ӧ�ʹ��ӦIƽ�������ƶ�
C.�����������䣬��ͼ1��֪���ȱ���ת�������¶ȵ����߶�����
D.��ͼ2 ��֪����Ҫ���C6H5-SH �IJ�����������������ȱ���ʼ���ʵ���֮��
��590��ʱ���ȱ�������������(�����1:2.5�������ʵ���amol)��VL�Ĺ̶��ݻ��н��з�Ӧ���ﵽƽ��ʱ����������б���ӵ����ʵ���Ϊa/7mol���������ʵ���Ϊa/l4mol������¶��·�ӦI��ƽ�ⳣ��Ϊ____��(������λ��Ч����)
�������ͼ1��ͼ2������ͼ�л������º��������·�Ӧ�����ﱽ��ӵ����ʵ���Ũ����ʱ��仯������ͼ________

(3)���������Ϸ����Ʊ���������⣬��ɵ�ԭ������(C6H5-SO3H��һԪǿ��)���������Ʊ�����п��ʯīΪ�缫������Ϊ�������Һ����ⱽ����ʱ��������ӦʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ղ��ʱ��ͨ����ľ��ܿ�һЩ����ȼ�ո�����������Ϊ�� ��
A.ʹ��̺Ϳ�����ֽӴ�
B.ɢ�ȵ����ʿ�
C.ľ���ǿ�ȼ��
D.���Խ����Ż��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ຣ���ҹ����ļ��β��أ�ij���Ƶõļ��Σ���Ҫ�ɷ�ΪKCl������MgCl2��CaCl2��K2SO4�Լ���ɳ�����ʣ������Ǵּ����ᴿ��ʵ�鷽������������������ͼ������ѡ�õ��Լ�Ϊ��NaOH��Һ��KOH��Һ��Ba(OH)2��Һ��HCl��Һ��H2SO4��Һ��HNO3��Һ��Na2CO3��Һ��K2CO3��Һ

��1������Ca(OH)2�������dz�ȥ��Һ�е�Mg2+��д���÷�Ӧ�Ļ�ѧ����ʽ___________��
��2�������ٺͲ����ڶ����õ����������ֱ�д���������ڲ����ٺͲ������е�����___________��_______________��
��3���Լ��١��Լ��ڡ��Լ��۷ֱ�Ϊ__________��____________��______________�����ڲ�����֮ǰ�����Լ�����ʲô���___________________________________��
��4����������Һ���ǣ�Ӧ��β���___________________________________________��
��5�������ijɷ��У���ɳ��Mg(OH)2��BaSO4��CaCO3��_______________��
��6�������Լ�����������������Լ������ȻҪ��ȥ���������Լ�������γ�ȥ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mL0.1mol/LNH4HSO4��Һ�еμ�0.1mol/L��NaOH��Һ��������ҺpH��NaOH��Һ����Ĺ�ϵ������ͼ��ʾ������˵����ȷ����

A. a��b��c��d�ĸ����У�ˮ�ĵ���̶�������d
B. �����£�NH3��H2O�ĵ���ƽ�ⳣ��Kb=5��10-6
C. b����Һ�У�c(Na+)+c(NH4+)=c(SO42��)
D. c����Һ�У�3c(Na+)= 4[c(SO42��) +c(NH4+)+ c(NH3��H2O)]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���̣����ڷ��ȷ�Ӧ����(����)
��ˮ�������Һ̬ˮ��������кͷ�Ӧ ��Ũ����ϡ�͡���̼�������̼���� ��H2��Cl2��ȼ�� ���Ȼ��Ƶ���
A.�ڢۢܢ�B.�ڢۢ�C.�ڢ�D.�٢ۢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com