
【题目】苯硫酚(C6H5-SH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(C6H5-Cl)和硫化氢(H2S)反应来制备苯硫酚,但会有副产物苯(C6H6) 生成。
I: C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
C6H5-SH(g)+HCl(g) △H1=-16.8 kJ/mol
II: C6H5-Cl(g)+H2S(g)=C6H6(g)+HCl(g)+ ![]() S8(g) △H2
S8(g) △H2
反应II的焓变不易测量,现查表得如下数据:
Ⅲ: C6H5-SH(g)==C6H6(g)+ ![]() S8(g) △H3=-29.0 kJ/mol
S8(g) △H3=-29.0 kJ/mol
请回答:
(1)反应II为不可逆反应,请简述理由______________。
(2)现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20分钟测定生成物的浓度,得到图1和图2。
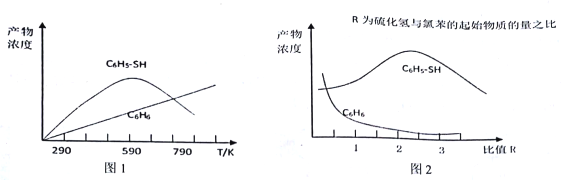
①下列说法不正确的是____________。
A.由图1可知,相同条件下反应I的活化分子百分数大于反应II 的活化分子百分数
B.图1中C6H5-SH 的浓度在590℃随温度变化的原因可能是反应II 中消耗反应物,使反应I平衡逆向移动
C.其他条件不变,由图1可知,氯苯的转化率随温度的升高而降低
D.由图2 可知,若要提高C6H5-SH 的产量,可提高硫化氢与氯苯起始物质的量之比
②590℃时,氯苯和硫化氢混合气体(体积比1:2.5,总物质的量amol)在VL的固定容积中进行反应,达到平衡时,测得容器中苯硫酚的物质的量为a/7mol,苯的物质的量为a/l4mol,则该温度下反应I的平衡常数为____。(保留两位有效数字)
③请根据图1、图2,在右图中画出恒温恒容条件下反应主产物苯硫酚的物质的量浓度随时间变化的曲线图________

(3)除了用以上方法制备苯硫酚以外,亦可电解还原苯磺酸(C6H5-SO3H,一元强酸)或苯磺酰氯来制备。以锌和石墨为电极,硫酸为电解质溶液,电解苯磺酸时的阴极反应式为_______。
【答案】 反应II △H2=-45.8kJ/mol<0,△S>0,说明其正反应是自发反应,而逆反应为非自发反应,所以反应II为不可逆反应 CD 0.86 如图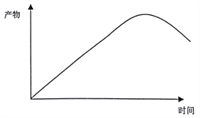 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O
C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O
【解析】(1)本题考查热化学反应方程式的计算、化学反应进行的方向,根据III,II-I,得出△H3=△H2-△H1,求出△H2=-45.8kJ·mol-1,根据△G=△H-T△S,因为△H2<0,△S>0,说明其正反应是自发进行,而逆反应为非自发进行;(2)本题考查化学反应条件的控制、化学平衡常数的计算,①A、根据图①反应I的化学反应速率比反应II快,说明相同条件下,反应I的活化分子百分数大于反应II活化分子百分数,故A说法正确;B、根据反应I和反应II的化学反应方程式,氯苯和硫化氢都是反应物,因为反应II是不可逆反应,升高温度,反应II中消耗氯苯和硫化氢,相当于减少反应I中反应物的浓度,平衡向逆反应方向进行,苯硫酚的浓度降低,故B说法正确;C、根据图1,反应II中氯苯的转化率随温度的升高而升高,故C说法错误;D、根据图2,在提高硫化氢与氯苯起始物质的量之比时,苯硫酚的浓度反而降低,故D说法错误;②C6H5-Cl(g)+H2S(g)![]() C6H5-SH(g)+HCl(g)
C6H5-SH(g)+HCl(g)
变化物质的量: a/7 a/7 a/7 a/7
C6H5-Cl(g)+H2S(g)===C6H6(g)+HCl(g)+ ![]() S8(g)
S8(g)
变化的物质的量: a/14 a/14 a/14 a/14 开始时,氯苯的总物质的量为![]() ,硫化氢总物质的量为
,硫化氢总物质的量为![]() ,达到平衡时,氯苯的物质的量为
,达到平衡时,氯苯的物质的量为 ,硫化氢物质的量为
,硫化氢物质的量为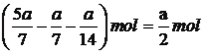 ,根据化学平衡常数的表达式,K=
,根据化学平衡常数的表达式,K= 0.86;③根据图1和图2,随着反应的进行苯硫酚的浓度增加,然后降低,因此图像是
0.86;③根据图1和图2,随着反应的进行苯硫酚的浓度增加,然后降低,因此图像是 ;(3)本题考查电极反应式的书写,根据电解原理,阴极上得到电子,化合价降低,发生还原反应,环境是酸性,因此电极反应式为 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O。
;(3)本题考查电极反应式的书写,根据电解原理,阴极上得到电子,化合价降低,发生还原反应,环境是酸性,因此电极反应式为 C6H5-SO3H+6H+ +6e- = C6H5-SH +3H2O。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列物质之间的相互关系错误的是( )
A.12C和13C互为同位素
B.(CH3)2CHCH2CH3和CH3CH2C(CH3)3互为同分异构体
C.CH3CH3和CH3(CH2)3CH3互为同系物
D.O2和O3互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据中,前者刚好是后者两倍的是 ( )
A. 2 mol H2O的摩尔质量和1 mol H2O的摩尔质量
B. 200 mL 1 mol·L-1氯化钙溶液中c(Cl-)和100 mL 2 mol·L-1氯化钾溶液中c(Cl-)
C. 64 g二氧化硫中氧原子数和标准状况下22.4 L一氧化碳中氧原子数
D. 20% NaOH溶液中NaOH的物质的量浓度和10% NaOH溶液中NaOH的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所选装置或实验设计合理的是

A. 用图①和②所示装置可以除去Na2CO3中的CaCO3杂质,并获得Na2CO3固体
B. 用乙醇提取溴水中的溴选择图③所示装置
C. 用图④所示装置可以分离乙醇水溶液
D. 图⑤所示装置中盛有饱和Na2SO3溶液除去SO2中含有的少量HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X由两种元素组成,为探究其组成和性质,设计并完成如下实验:
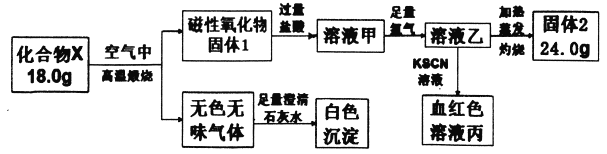
请回答:
(1)X的化学式是________。
(2)溶液甲与足量氯气反应的离子方程式为____________。
(3)加热条件下氨气被固体2氧化成一种气体单质,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】混合物也有摩尔质量,称为平均摩尔质量(符号:![]() ),以下关于
),以下关于![]() 的算法错误的是
的算法错误的是
A. 某混合气体在标准状况下密度ρ=1.429g/L,则该混合气体的![]() =32g/mol
=32g/mol
B. 已知某CO和CO2组成的混合气体的![]() =30g/mol,则CO和CO2的体积比为7:1
=30g/mol,则CO和CO2的体积比为7:1
C. 已知反应:(NH4)2CO3 ![]() 2NH3↑ + H2O↑ + CO2↑,一定量的(NH4)2CO3固体完全分解后所得混合气体(温度200°C下)的
2NH3↑ + H2O↑ + CO2↑,一定量的(NH4)2CO3固体完全分解后所得混合气体(温度200°C下)的![]() =26.3g/mol
=26.3g/mol
D. 一定温度和压强下,空气的密度是氢气密度的14.3倍,则此时空气![]() =28.6g/mol
=28.6g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:

(1)该“84消毒液”的物质的量浓度约为____________mol·L-1(保留两位有效数字)。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=________ mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为37.25%的消毒液。下列说法正确的是________(填字母)。

A、如图所示的仪器中,有三种是不需要的,另外还需要一种玻璃仪器
B、容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C、配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D、需要称量NaClO固体的质量为214.6 g
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组需要500mL 1.2mol·L-1的稀硫酸,所用原料为98%(密度为1.84 g·cm-3)的浓硫酸。
①所配制的稀硫酸中,H+的物质的量浓度为________ mol·L-1。
②需用量筒量取浓硫酸的体积为________mL。
③容量瓶使用前需检查是否漏水,应如何检查__________________________。
④下列操作会使所配稀硫酸浓度偏高的是______________。
A、取用浓硫酸时仰视刻度线
B、容量瓶用蒸馏水洗涤后用1.2mol/L的硫酸润洗
C、转移溶液时,不慎有少量溶液洒出
D、定容时仰视容量瓶刻度线
E、将稀释后的稀硫酸立即转入容量瓶且进行后面的实验操作
F、定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴 蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关。下列叙述正确的是
A. 鲜榨橙汁遇碘水会变蓝 B. 馒头越嚼越甜
C. 油脂经水解可变成葡萄糖 D. 土豆中的淀粉经水解可变成酒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各个反应,不能用于工业生产的是( )
A.焦炭在高温下还原二氧化硅制粗硅
B.电解熔融氧化铝制金属铝
C.二氧化碳和氢氧化钠反应制碳酸钠
D.氯气与石灰乳反应制漂白粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com